Natrium azida (NAN3) struktur, egenskaper, användningar, risker

- 4493
- 732
- Hans Olsson
De Natriumazid Det är ett kristallint oorganiskt fast ämne som bildas av natriumjonen Na+ Och azida non3-. Dess kemiska formel är nan3. Nanföreningen3 Det är natriumsaltet av HN -hydrazoesyra3. Nan3 Det är ett kristallint fast ämne av färglöst till vitt.
Även om det är en mycket giftig förening har ett av dess mest utbredda jobb varit på krockkuddarna som omedelbart är infekterade under fordonsolyckor. Det tjänar också till att snabbt blåsa upp flygplanets nödsituationer. Men för närvarande ifrågasätts dess användning mycket i båda fallen för dess toxicitet.
 Natrium nan azid3 fast. И.С. Ноконов [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons.
Natrium nan azid3 fast. И.С. Ноконов [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons. Det används i kemiska forskningslaboratorier för att syntetisera olika typer av föreningar och i biokemiska laboratorier för studier med bakterier, svampar eller däggdjur eller mänskliga celler.
I vissa laboratorier används det för att sterilisera material eller utrustning, men vissa typer av mikroorganismer motstår deras biocidiska åtgärder.
Det har också använts i jordbruket för att eliminera markparasiter eller i timmerindustrin för att förhindra att tallved färgas med svampar.
[TOC]
Strukturera
Natrium azida nan3 Det bildas av en natrium -katjon+ och en azidanjon n3-.
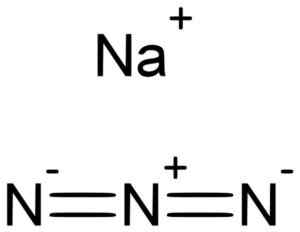 Natrium azida bildas av natrium NA+ Och azida non3-. Lukáš Mižoch [public domain]. Källa: Wikimedia Commons.
Natrium azida bildas av natrium NA+ Och azida non3-. Lukáš Mižoch [public domain]. Källa: Wikimedia Commons. Azida non3- Den består av 3 kväveatomer (n) förenade av varandra av kovalenta bindningar som kan vara enkla, dubbla eller trippel, eftersom elektroner delas mellan de tre.
Denna anjon har en linjär struktur, det vill säga de tre kväveatomerna arrangerade i en rak linje. Dessutom är strukturen symmetrisk.
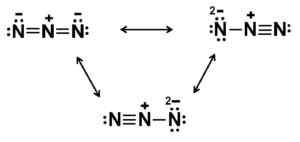 Möjliga Lewis -strukturer av Azida -anjon. Författare: Marilú Stea.
Möjliga Lewis -strukturer av Azida -anjon. Författare: Marilú Stea. Nomenklatur
- Natriumazid
- Natrium azida
Egenskaper
Fysiskt tillstånd
Kristallin fast färglös till vit. Hexagonala kristaller.
Molekylvikt
65,01 g/mol
Smältpunkt
Det sönderdelas vid 275 ºC.
Densitet
1 846 g/cm3 vid 20 ºC
Löslighet
Det är mycket lösligt i vatten: 41,7 g/100 ml vid 17 ºC. Det är något lösligt i etanol och olöslig i etyleter.
Dissociationskonstanter
Den har en PKb 9.3. Vattenlösningar innehåller NH3, som snabbt undgår miljön vid 37 ºC.
Kemiska egenskaper
Nan3 Det är mycket frätande mot aluminium och måttligt mot koppar och bly.
Kan tjäna dig: kvävevalenserEnligt en viss källa som konsulterats är natrium Azid inte explosiv. Den sönderdelas försiktigt och helt när den värms upp till 300 ° C eller mer, och bildar natriummetall och kvävgas N2.
2 nan3 → 2 na + 3 n2↑
Det är ett nitroringsmedel, detta innebär att det tjänar till kväve eller tillsätt kväve till andra kemiska föreningar eller till ytan på material som stål.
Det är stabilt i neutralt eller alkaliskt vatten i frånvaro av ljus. Det sönderdelas genom solstrålning.
Biokemiska egenskaper
Natriumazid hämmar ett enzym som kallas cytokromoxidas som finns i mitokondrierna i cellerna och är signifikant involverad i andning och energiproduktion i detta.
Dess åtgärd förhindrar ATP -generering från en nyckelförening i cellaktiviteter och cellen försämras eller skador.
Om det intas, inhaleras eller kontaktar med natrium aziden är den mycket giftig och kan bli dödlig.
Erhållande
NH ammoniak reagerar3 Med metall Sodio Na vid 350 ºC i en stängd stålbehållare, vilket får amid från natrium nanh2.
Natrium nanh2 Det reagerar med dyitrogenmonoxid n2Eller vid 230 ° C i en nickelreaktor, och därmed bildas en blandning av natriumnan3, Natriumhydroxid NaOH och ammoniak NH3.
2 nanh2 + N2O → nan3 + NaOH + NH3
Det kan också erhållas genom att reagera natriumamid med nano -natriumnitrat3 vid 175 ºC:
3 nanh2 + Äldre bror3 → Nan3 + 3 NaOH + NH3
För att rena aziden tillsätts vatten till blandningen, kristallerna i aziden tvättas och sedan avdunstar vattnet. Det kristallina materialet som återstår är nanens azid3 som sedan torkar vid 110 ºC.
Ansökningar
I motorfordon och flygplan
Natriumazid har använts allmänt inom bilindustrin som kvävegenerator för att snabbt blåsa upp Air Bracks (engelska Krockkuddar) Säkerhet för bilflygare och lastbilar när en påverkan inträffar.
Det har också använts i uppblåsbara bilder som tjänar till att snabbt fly från det inre av planen som har landat i nödsituationer.
I båda fallen involverar mekanismen verkan av en gnista för att producera den omedelbara reaktionen mellan natrium azid och vissa föreningar, vilket genererar kvävgas n2 och natriumoxid Na2ANTINGEN.
Kan tjäna dig: dubbel substitutionsreaktionDenna applikation kräver omedelbar frisläppande av en kall och icke-teknisk gas, så kväve är den mest lämpliga gasen.
 Säkerhetspåsar som redan har använts i fordon. Författare: Marcel Langthim. Källa: Pixabay.
Säkerhetspåsar som redan har använts i fordon. Författare: Marcel Langthim. Källa: Pixabay. Emellertid minskar denna användning på grund av toxiciteten hos natriumazid och används istället mindre giftiga föreningar.
I den kemiska industrin
Det används som retarder i gummitillverkning för svampar, för att förhindra koagulering av stretch eller butadienlatex när de lagras i kontakt med metaller och för att sönderdelas nitriter i närvaro av nitrater.
I jordbruket
Det har använts inom jordbruket: som biocidalt och rökmedel är det också nematicide, det vill säga den appliceras i jord för att eliminera nematoder, som är parasiter som attackerar vissa grödor.
 Skador orsakade av nematoder vid roten till en växt. Författare: Redwolf. [http: // www.Ars-grin.GOV/ARS/SOATLANTIC/FP/STPP/BURELLE/BURELLE.HTML] Källa: Wikimedia Commons.
Skador orsakade av nematoder vid roten till en växt. Författare: Redwolf. [http: // www.Ars-grin.GOV/ARS/SOATLANTIC/FP/STPP/BURELLE/BURELLE.HTML] Källa: Wikimedia Commons. Det har också fungerat som herbicid och för att undvika ruttna frukter.
Nyligen nan3 Det har använts vid beredningen av okra eller quimbombó frön för att observera dess motstånd mot vattenvattensförhållanden.
Frön som Nan tidigare tillämpades3 De genererade plantor som bättre drog tillbaka översvämningsförhållandena än de orimliga, förbättrade växternas höjd, ökade antalet blad och ökade mängden rötter även med överskottet av vatten.
Vid framställning av andra kemiska föreningar
Det används som ett kemiskt reagens i syntesen av organiska föreningar, till exempel för att framställa många organiska azider, såsom den tertiära alkylgruppen azider, som är viktiga i kemisk syntes.
Det tjänar till att framställa hydrazoinsyra (HN3) och rent natrium (NA).
I den explosiva industrin
Natrium azida nan3 Det är en mellanhand i explosiv tillverkning, eftersom den används för beredning av bly Azid3)2. Det senare är en förening som exploderar när den slås starkt, så den används vid konstruktion av detonerande enheter.
 Natrium azida nan3 Det används för att tillverka PB -ledningen (n3)2 sammansatt som är en del av enheter för att generera explosioner. Författare: OpenClipart-Vectors. Källa: Pixabay.
Natrium azida nan3 Det används för att tillverka PB -ledningen (n3)2 sammansatt som är en del av enheter för att generera explosioner. Författare: OpenClipart-Vectors. Källa: Pixabay. I biokemiska laboratorier
Natriumazid används när steril laboratorieutrustning krävs, eftersom den kan förstöra olika typer av mikroorganismer.
Det kan tjäna dig: hypofysyra (H3PO2): egenskaper, användningar och reagensDet är ett biocidalt medel. Vissa källor indikerar dock att vissa typer av bakterier är resistenta mot deras verkan.
Detta uppnås genom att blockera det syrebindande stället i oxidascytokrom som är ett enzym involverat i energiproduktionsprocessen för vissa mikroorganismer.
Det används i automatiska blodräknare, även i det differentiella urvalet av bakterier och för att bevara laboratoriereagenslösningar eftersom det förhindrar tillväxten av vissa mikroorganismer i dessa.
I flera användningsområden
Natrium Azida tjänar i träindustrin för att undvika tillväxten av bruna svampar på tallved.
Det har också använts i den japanska ölindustrin för att undvika utvecklingen av en svamp som mörknar den drycken.
Risker
Natriumazid är en toxisk förening som hämmar ett viktigt enzym för andning och liv hos mänskliga och djurceller. Det har visat sig att det allvarligt kan påverka cellvävnadscellerna i hjärnblodkärlet.
Dess omedelbara effekt efter intag, inandning eller hudkontakt är att sänka blodtrycket farligt, vilket kan leda till döden. Därför måste det manipuleras med stor försiktighet.
Det finns informationskällor som lockar uppmärksamhet till fordonens krockkuddar som förstörs på avfallsgrunder.
I sådana fall kan människor som inte vet faran få tillgång till NAN -insättningar3, Detta är en mycket giftig förening. Dessutom finns det en fara för föroreningar med NAN3 jord och vatten.
Likaså, under olyckor, kollisioner eller fordonsbränder kan människor utsättas för NAN3 Och detta kan underskattas eller okänt av den medicinska personalen som deltar i nödsituationen.
Uppmärksamhet på utställningen av laboratoriepersonal som använder den har också kallats.
Referenser
- Vwioko, e.D. et al. (2019). Natriumazidprimning förbättrar vattendragningstoleransen i okra (Abelmoschus esculentus). Agronomy 2019, 9, 670. MDPI återhämtade sig.com.
- Kho, D.T. et al. (2017). Död av blodhjärnbarriär endotelceller till natriumazid och dess gasformiga produkter. Biosensors 2017, 7, 41. MDPI återhämtade sig.com.
- ELLER.S. National Library of Medicine. (2019). Natriumazid. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov.
- Talavera, m. et al. (2019). Nematodhantering i jordgubbsfält i södra Spanien. Agronomy 2019, 9, 252. MDPI återhämtade sig.com.
- Okano, T. et al. (nittonhundranittiofem). Mekanism för cellavskiljning från temperaturmodulerad, hydrofilhydrofoba polymerytor. I biomaterial: Silver Jubilee Compendium. Återhämtat sig från Scientedirect.com.
- Ullmanns Encyclopedia of Industrial Chemistry. (1990). Femte upplagan. Volym A22. VCH Verlagsgellschaft MBH.
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Chang, s. och lamm, s.H. (2003). Mänskliga hälsoeffekter av exponering för natriumazid: En litteraturöversikt och analys. Int J Toxicol 2003, 22 (3): 175-86. NCBI återhämtade sig.Nlm.Nih.Gov.

