Butanonstruktur, egenskaper och användningar
- 964
- 119
- Johan Eriksson
De Butanon Det är en organisk förening, särskilt en keton, vars kemiska formel är Cho3Ch2Spetsa3. Dess utseende är det av en färglös vätska som används i grunden som ett lösningsmedel. Det har liknar acetonegenskaper, men koka vid en högre temperatur och förångas långsammare.
Det produceras av den katalytiska dehydrogeneringen av 2-butanol (chiral förening). Det är emellertid i naturligt tillstånd i sammansättningen av vissa frukter. Det är en del av utsläppen av fordonets avgasrör och är en del av tobaks rök.
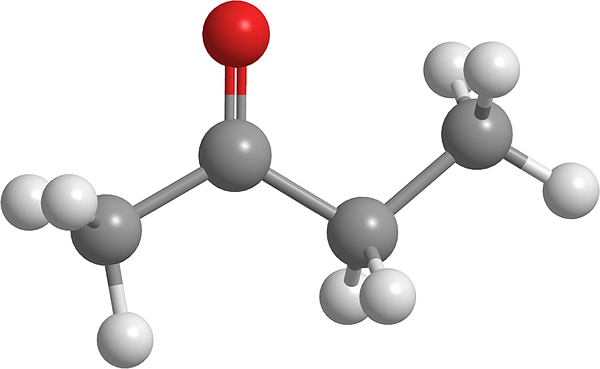
 Butanonmolekyl. Källa: Pixabay.
Butanonmolekyl. Källa: Pixabay. Det är efter aceton det enklaste av denna familj av organiska föreningar. Butnonone orsakar irritation i ögonen och näsan. I ovanligt hög dos kan det orsaka irritation i lungslemhinnan. Å andra sidan betraktas denna vätska som ett föregångare för narkotika.
Butanon har stor löslighet i vatten; Men det är också mycket lösligt i organiska lösningsmedel såsom etanol, eter, aceton, bensen och kloroform. Detta kan förklaras eftersom dess värde på P -loggen (0,29) för oktan/vattenpartitionskoefficienten är låg.
[TOC]
Butanonstruktur
I den övre bilden visas butanonmolekylen med en sfärer och staplarmodell. Syreatomen i karbonylgruppen (röd sfär) kan ses i det andra kolet. Denna grupp, C = O, ansvarar för att ge ett permanent dipolmoment till molekylen.
Butanon, strukturellt vy, är inget annat än en aceton som en metylengrupp har lagts till, Ch2. Med fler kol, är dipolmomentet mindre jämfört med aceton; Men dess största molekylmassa får den att koka vid en högre temperatur.
Denna molekyl, liksom andra ketoner, saknar möjligheten att bilda vätebroar; Och därför är deras dipol-dipolo-interaktioner inte så starka.
Kan tjäna dig: Emulgifiering: Emulsionsprocess, molekylära aspekter, applikationerDet är därför det är en flyktig vätska. När temperaturen sjunker (-86,6 ° C) är dess svaga dipoler de som leder deras molekyler för att bilda en kristall. Utöver detta kan det också kommenteras att butanon är strukturellt asymmetrisk.
Egenskaper
Molekylär formel
C4H8Eller ch3Spetsa2Ch3
Namn
- Butanon.
- 2-butanon.
- Butan -2 -ona.
- Metyl Ethil Cetona.
Molmassa
72.107 g/mol.
Fysisk beskrivning
Färglös vätska.
Lukt
Doftande till mynta, måttligt stark.
Kokpunkt
79.59 ºC vid 760 mmHg.
Smältpunkt
-86.6 ºC.
antändningspunkt
-9 ºC (stängd kopp).
Vattenlöslighet
29 g /100 ml vid 20 ºC. Medan dess dipolmoment är mindre än för aceton, kan det fortfarande interagera i en utmärkt grad med vattenmolekyler. Från dem tar emot vätebroar: (ch3) (Ch2Ch3) C = O-HAH. På grund av detta är mycket lösligt i vatten.
Löslighet i organiska lösningsmedel
Löslig i bensen, alkohol och eter; Belopp med oljor, etanol, eter, aceton, bensen och kloroform. Observera att butanon är lösligt i en mängd olika lösningsmedel.
Densitet
0,7997 g/cm3 vid 25 ºC.
Ång-densitet
2,41 (i förhållande till vatten = 1).
Ångtryck
90,6 mmHg vid 25 ºC.
Oktanol/vattenpartitionskoefficient
Log P = 0,29
Självtemperatur
505 ºC.
Sönderfall
Det sönderdelas genom fotokemiska processer genom oxidation genom fri hydroxylradikal. När den värms upp till sönderdelning avger en tunnland rök.
Gegga
0,40 CPOISE vid 25 ºC.
Förbränningsvärme
2.444,1 kJ/mol vid 25 ° C.
Förångningsvärme
31.30 kJ/mol vid kokpunkten; och 34,79 kJ/mol vid 25 ° C.
Kan tjäna dig: allmän gaslagYtspänning
23,97 mn/m a 25 ºC.
Joniseringspotential
0,54 eV.
Lukttröskel
Låg lukt: 0,735 mg/m3.
Hög lukt: 147,5 mg/m3.
Brytningsindex
1 788 till 20 ºC.
Dissociationskonstant
PKA = 14,70.
Stabilitet
Stabil, men mycket brandfarlig. Oförenlig med oxiderande medel, baser och starka reducerande medel. Fukt bör undvikas.
Ansökningar
Lösningsmedel
Butanon används som ett lösningsmedel i utarbetandet av ytbeläggningar, tillverkning av rökfri damm, färgade hartser utarbetande och vid eliminering av fettansamling som produceras av smörjmedel.
Dessutom används det vid utarbetandet av:
- Konstgjort läder.
- Gomas.
- Lakor.
- Lack.
- Lim.
- Lösningsmedel.
- Målarinsatser.
- Lim.
- Plastcement.
- Tätning.
- Magnetband.
- Transparent papper.
- Tryckfärger.
- Kosmetika och läkemedelsprodukter.
Det används också som ett lösningsmedel för defidering av metallytor, rengöringsmedel för elektronisk utrustning och fettuttag. Det tjänar för extraktion av hårt trä och vegetabilisk olja.
Det är en inert ingrediens i utarbetandet av bekämpningsmedel och i tillverkningen av acetat- och cellulosanitrat.
Det används som extraktionslösningsmedel vid livsmedelsbearbetning och livsmedelsingredienser; Till exempel i fraktioneringen av fetter och oljor, såväl som i kaffe -koffeinhalten. Det används också som lösningsmedel i markörerna som används i vita brädor.
Reagens
- Butanon används som vattenlöslig fotoiniciator.
- Den kondenserar med formaldehyden för att producera isopropenil keton.
- Upplev autokodens för produktion av etylamylo cetona.
- Reagerar med citral för att få parfymkomponenter som metylpseudoionon.
Kan tjäna dig: reaktionsvärme- Det ingriper som en katalysator i hydraccinproduktion.
- Dessutom är det en föregångare till metyletylcetona peroxid, som är en katalysator för vissa polymerisationsreaktioner.
Plastcement
Butanone har applicering som plastsvetmedel, med användning i montering av polystyrenskala modeller. Butnonon upplöser polystyren, vilket gör att kanterna kan gå med när en ny polymerisation inträffar. Detta beteende är av en cement och inte av ett lim.
Andra användningsområden
Butanon används som sterilisator av bakteriesporer i kirurgiinstrument, nålar, hypodermala injektorer och tandinstrument.
Det används som ett smakmedel för mat i mycket låga koncentrationer; I alkoholhaltiga drycker är koncentrationen till exempel 20 ppm; i bakade produkter, 12,7 ppm; Köttet har cirka 26,5 ppm; tugga gummi, 0,63 ppm; och i fetter och oljor, 1,0 ppm.
Och slutligen används butanon vid separationen av hemoproteingruppen apoprotein i hemoproteiner.
Referenser
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. 5ta Utgåva. Redaktör Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. Aminer. (10thUtgåva.). Wiley Plus.
- Nationellt centrum för bioteknikinformation. (2019). Metyletyl keton pubchem databas. CID = 6569. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Wikipedia. (2019). Butanon. Hämtad från: i.Wikipedia.org
- Royal Society of Chemistry. (2015). Butanon. Tanka. Återhämtat sig från: chemspider.com
- Arlem Cheprasov. (2019). Vad är Butanone? Formel och användning. Studie. Återhämtat sig från: studie.com
- Ben Verve. (17 maj 2017). Butanon. Kemivärld. Återhämtat sig från: Chemistryworld.com

