Kaliumkarbonat (K2CO3) struktur, egenskaper, användningar, erhållning

- 1411
- 0
- Johan Gustafsson
han Kaliumkarbonat Det är en oorganisk förening bildad av två kaliumjoner K+ och en koljon CO32-. Dess kemiska formel är k2Co3. Det är ett hygroskopiskt vitt fast ämne, det vill säga det absorberar lätt vattnet från miljön. Därför används det i laboratorier för att absorbera vatten från andra ämnen.
Det är mycket lösligt i vatten som bildar alkaliska lösningar, som är rika på OH -joner-och därför med ett högt pH -värde. Dess vattenhaltiga lösningar, eftersom de är alkaliska, används i flera industriella processer för att absorbera syragaser såsom koldioxid2 och vätesulfid h2S, sedan neutraliserar dem lätt.
 Kaliumkarbonat k2Co3 fast. Ondřej Mangl [Public Domain]. Källa: Wikimedia Commons.
Kaliumkarbonat k2Co3 fast. Ondřej Mangl [Public Domain]. Källa: Wikimedia Commons. K: t2Co3 Det används för att förbereda tvålar, rengöringsprodukter, tvättmedel för tvätt av kläder och blandningar för att tvätta rätter. Det används också vid bearbetning av vissa textilfibrer som ull.
Det används allmänt i kemilaboratorier, till exempel för att absorbera vatten från andra föreningar eller för att alkalisera blandningar av kemiska reaktioner och även i kemisk analys.
Det läggs också till vissa livsmedel, till exempel för att eliminera den bittera smaken av kakaofrön under chokladproduktion.
[TOC]
Strukturera
Kaliumkarbonat består av två kalium K -katjoner+ och en karbonatanjon co32-. Karbonatanjonen har en platt och symmetrisk struktur, medan de tre syreatomerna omger kol som bildar en platt triangel.
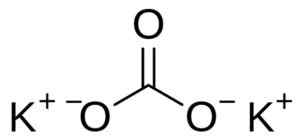 Kaliumkarbonatstruktur k2Co3. Användare: Edgar181 [Public Domain]. Källa: Wikimedia Commons.
Kaliumkarbonatstruktur k2Co3. Användare: Edgar181 [Public Domain]. Källa: Wikimedia Commons. Nomenklatur
- Kaliumkarbonat
- Kaliumkarbonat
- Dipotasiumkarbonat
- Kali
- Kolsyrasalt.
Egenskaper
Fysiskt tillstånd
Kristallin fast färglös till vit.
Molekylvikt
138 205 g/mol.
Smältpunkt
899 ºC.
Kokpunkt
Det sönderdelas.
Densitet
2,29 g/cm3
Löslighet
Mycket lösligt i vatten: 111 g/100 g vatten vid 25 ° C. Olöslig i etanol och aceton.
Kan tjäna dig: bidrag från kemi till medicinpH
En vattenlösning kan ha ett pH på 11,6, det vill säga det är ganska alkaliskt.
Kemiska egenskaper
Kaliumkarbonat är delikat eller hygroskopiskt, det vill säga det absorberar miljöens fuktighet. Den har ett stabilt hydrat, K2Co3.2h2ANTINGEN.
K: t2Co3 I vattenlösning är den hydrolyserad, det vill säga den reagerar med vattnet genom att släppa OH -grupper- Vilka är de som ger alkalinitet till lösningarna:
Co32- + H2Eller ⇔ Åh- + Hco3-
Hco3- + H2Eller ⇔ Åh- + H2Co3
Erhållande
Kan erhållas från den återstående aska vid brinnande växter. Även genom kolsyrning av KOH kaliumhydroxid, det vill säga att lägga till överskott av koldioxid CO2 Till Koh:
KOH + CO2 → Khco3
2 khco3 + Värme → K2Co3 + H2ANTINGEN
Ett annat sätt att få det är att värma KCL kaliumklorid med magnesiumkarbonat3, vatten och co2 under press. Ett dubbel hydratiserat magnesium och kaliumsalt och kalium erhålls först3.Khco3.4 timmar2Eller kallas Engels Salt:
2 kcl + 3 mgco3 + Co2 + 5 h2O → mgco3.Khco3.4 timmar2Eller ↓ + mgcl2
Det dubbla hydratiserade saltet av Engels faller ut och separeras från lösningen genom filtrering. Då värms kaliumbilkarbonatet och bildas2Co3 Det genom att tillsätta vatten upplöses medan MGCO magnesiumkarbonat3 förblir olöslig och eliminerad genom filtrering.
Mgco3.Khco3.4 timmar2O + värme → MGCO3↓ + 2 K+ + Co32- + Co2↑ + 9 h2ANTINGEN
Ansökningar
Vid absorptionen av CO2 I industriella processer
Kaliumkarbonatlösning är den klassiska behandlingen för koldioxidborttagning CO2 I olika processer, särskilt i höga tryck och temperaturer applikationer.
 K -lösningar2Co3 De är vana att absorbera CO2 I olika industriella processer. Författare: Nicola Giordano. Källa: Pixabay.
K -lösningar2Co3 De är vana att absorbera CO2 I olika industriella processer. Författare: Nicola Giordano. Källa: Pixabay. Avlägsnande av CO2 inträffar enligt följande reaktion:
K2Co3 + Co2 + H2Eller ⇔ 2 khco3
Denna metod används till exempel för att behandla naturgas. Också i energiproduktionsanläggningar, för att undvika utsläpp av CO2 till atmosfären och i produktion av torr is.
Kan tjäna dig: kopparhydroxid (ii): struktur, egenskaper, nomenklatur, användningar K -lösningar2Co3 De används för att få CO2 som tjänar till att göra torris. ProjectManhattan [CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons.
K -lösningar2Co3 De används för att få CO2 som tjänar till att göra torris. ProjectManhattan [CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons. K -lösning2Co3 Det kan vara termiskt regenererat, det vill säga på grund av temperaturer värmer upp cirka 100 ° C.
För att kaliumkarbonatlösning ska absorbera CO2 med god hastighet tillsätts promotorer som påskyndar processen såsom dietanolamin (DEA).
Vid avlägsnande av h2S av vissa processer
Kaliumkarbonatlösningar används också för att ta bort vätesulfidgas h2S av processströmmar. Ibland tillsätts kaliumtiffosfat K3Po4 För att göra snabbare processen.
I kemilaboratorier
K: t2Co3 Tillåter organisk syntes, till exempel i kondensationsreaktioner och att neutralisera. Det tjänar till att ta bort vatten från organiska vätskor, som ett dehydratiserings- eller torkmedel i laboratoriet.
Det används också i analytiska kemi -reaktioner och för att alkalisera i läkemedelsindustrin.
Inom rengöringsproduktbranschen
K: t2Co3 Det används för att tillverka tvål, rengöring av formler, produkter för kläder och tvätt av rätter och även för att förbereda schampo och andra personliga vårdprodukter.
 K: t2Co3 Det används i tvålberedning. Lacrosus [allmän domän]. Källa: Wikimedia Commons.
K: t2Co3 Det används i tvålberedning. Lacrosus [allmän domän]. Källa: Wikimedia Commons. I livsmedelsindustrin
Kaliumkarbonat tillsätts till olika livsmedel med flera syften.
Till exempel läggs det till kakaofrön för att eliminera deras bittera smak och använda dem i chokladproduktion. Det läggs till druvorna i torkningsprocessen för att få raisiddruvor.
 Kakaofrön behandlas med k2Co3 För att minska sin bittera smak när du gör choklad. Författare: Magali Couret. Källa: Pixabay.
Kakaofrön behandlas med k2Co3 För att minska sin bittera smak när du gör choklad. Författare: Magali Couret. Källa: Pixabay. I konditorivaror används det som en leudant (fungerar som en jäst) av mjölet för att förbereda bakade livsmedel.
Kan tjäna dig: lutecio: struktur, egenskaper, användningar, erhållning K: t2Co3 Det kan användas som en ledare i kakor för när det avger co2 Under matlagning av dessa ökade volymen. Författare: Pixel1. Källa: Pixabay.com
K: t2Co3 Det kan användas som en ledare i kakor för när det avger co2 Under matlagning av dessa ökade volymen. Författare: Pixel1. Källa: Pixabay.com I gödningsmedel
K: t2Co3 Det är van vid att gödsla syrajordar, som koljonen Co32- I kontakt med vatten producerar OH -joner- som ökar markens pH. Förutom kalium k+ Det är ett näringsämne för växter.
Kaliumkarbonat har också använts för att göra långsam gödselmedel.
En långsam frisläppande gödningsmedel eller lösa näringsämnen så att de inte löses och dras av vatten. Tack vare detta kan de spendera mer tid tillgängliga för växtrötter.
I flera applikationer
Kaliumkarbonat k2Co3 Det används också för:
- Torkning, blekt och rena ullrengöringsprocesser och andra textilindustriaktiviteter
- Att få andra organiska och oorganiska kaliumsalter, såsom KCN -kaliumcyanid.
- Fungera som en surhetsregulator i olika processer.
- Gör keramik och keramik.
- Graverings- och litografiprocesser.
- Solbränna.
- Förbered utskriftsfärger, pigment.
- Guldresglas2Co3 Det är mer kompatibelt än för natriumkarbonat na2Co3 Med bly-, barium- och strontiumoxider som dessa glas innehåller.
- Vattenbehandling.
- Försena eld (i form av vattenhaltiga lösningar).
- Hämta korrosion och som ett anti-caring-medel i processteam.
Referenser
- ELLER.S. National Library of Medicine. (2019). Kaliumkarbonat. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Steele, D. (1966). Kemin för de metalliska elementen. Pergamon Press Ltd. London.
- Mokhatab, s. et al. (2019). Naturgasbehandling. Kaliumkarbonatlösningen. I Handbook of Natural Gas Transmission and Processing (Fourth Edition). Återhämtat sig från Scientedirect.com.
- Kakaras, E. et al. (2012). Trycksatt fluidiserad bäddförbränning (PFBC) kombinerade cykelsystem. Trycksatt fluidiserad bäddförbränning med kolupptagning och lagring. I kombinerade cykelsystem för nästan nollutsläppskraftproduktion. Återhämtat sig från Scientedirect.com.
- Speight, J.G. (2019). Väteproduktion. Våtskrubbning. I tung oljeåtervinning och uppgradering. Återhämtat sig från Scientedirect.com.
- Branan, c.R. (2005). Gasbehandling: Kapitel uppdaterat av Chris Higman. Hett karbonatprocess. I tumregler för kemiska ingenjörer (fjärde upplagan). Återhämtat sig från Scientedirect.com.
- Kirk-THERMER (1994). Encyclopedia of Chemical Technology. Fjärde upplagan. John Wiley & Sons.
- Ullmanns Encyclopedia of Industrial Chemistry. (1990). Femte upplagan. VCH Verlagsgellschaft MBH.
- Li och. och Cheng, f. (2016). Syntes av en ny långfrisättning av kaliumgödselmedel från modifierad pidgeon magnesiumslagg med kaliumkarbonat. J Air Waste Manag Assoc, 2016 aug; 66 (8): 758-67. NCBI återhämtade sig.Nlm.Nih.Gov.

