Zinkkarbonat (ZnCO3) struktur, egenskaper, användningar

- 3881
- 799
- PhD. Emil Svensson
han zinkkarbonat Det är en oorganisk förening som bildas av zink (Zn), kol (C) och syre (O) -element (O). Dess kemiska formel är Znco3. Zink har ett oxidationstillstånd på +2, kol +4 och syre -2.
Det är ett färglöst eller vitt fast ämne som finns i naturen som bildar Smithsonite Mineral, där det kan vara ensam eller med andra element som kobolt eller koppar, vilket ger det en violett respektive grön färgning respektive.
 Smithsonita, Znco Mineral3. Rob Lavinsky, irocks.com-cc-by-sa-3.0/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons.
Smithsonita, Znco Mineral3. Rob Lavinsky, irocks.com-cc-by-sa-3.0/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons. Znco3 Det är nästan olösligt i vatten, men det löses lätt i utspädda syror, som karbonatjon i sur karbononisk form (h2Co3), som sedan blir CO -gasen2 och vatten.
Det används som ett antiseptiskt medel i djursår och levereras ibland i kosten för att undvika sjukdomar orsakade av zinkbrist.
Det tjänar till att försena de brända som vissa fibrer, plast och tandkött när de kommer i kontakt med eld. Gör det möjligt att separera giftiga arsenikmineraler från andra stenar säkert.
Det har använts i tandpelspasta för att återhämta dentin i tänderna under blekning.
[TOC]
Strukturera
Znco3 Det bildas av en Zn -katjon2+ och en anjon co32-. Kol i karbonatjonen har ett oxidationstillstånd på +4. Denna jon har en platt struktur med de tre syreatomerna som omger kolatomen.
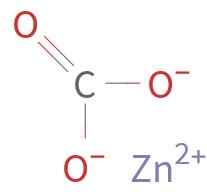 Kemisk struktur av zinkkarbonat. Okänd författare / allmän domän. Källa: Wikimedia Commons.
Kemisk struktur av zinkkarbonat. Okänd författare / allmän domän. Källa: Wikimedia Commons. Nomenklatur
- Zinkkarbonat
- Zinkmonokarbonat
- Karbonsyra zinksalt
- Smithsonita
- Zinkspett
Egenskaper
Fysiskt tillstånd
Färglöst fast eller kristallint vitt. Rombiska kristaller.
 Zinkkarbonat. Ondřej Mangl / Pub Domain. Källa: Wikimedia Commons.
Zinkkarbonat. Ondřej Mangl / Pub Domain. Källa: Wikimedia Commons. Molekylvikt
125,4 g/mol
Smältpunkt
Vid 140 ºC bryts det ner utan att smälta.
Densitet
4 398 g/cm3 vid 20 ° C.
Löslighet
Praktiskt taget olöslig i vatten: 0,000091 g/100 g h2Eller vid 20 ° C. Lösliga i utspädda syror, alkalier och ammoniumsalter. Olöslig i ammoniak, alkohol och aceton.
Kemiska egenskaper
Reagerar med syror som bildar koldioxid:
Znco3 + 2 h+ → Zn2+ + H2Eller + co2↑
Det löses upp i baser som bildar hydroxid, som delvis upplöstes och bildar en jon zinkto:
Kan tjäna dig: brom: historia, struktur, elektronisk konfiguration, egenskaper, användningarZnco3 + 2 åh- → Zn (OH)2 + Co32-
Zn (OH)2 + H2Eller + oh- → [Zn (OH)3(H2ANTINGEN)]-
Det är inte brandfarligt. När den värms upp till dess sönderdelning producerar zinkoxid och koldioxid, men kan avge kolmonoxid (CO) (CO).
Znco3 + Värme → Zno + Co2↑
Erhållande
Smithsonite Mineral erhålls, tidigare kallad Zinc's Spat.
Det kan också framställas genom att blanda en natriumkarbonatlösning med ett zinksalt, såsom zinksulfat. Natriumsulfat förblir upplöst och zinkkarbonat fälls ut:
Znso4 + Na2Co3 → Znco3↓ + na2Sw4
Ansökningar
I medicinska behandlingar
Denna förening låter dig få några farmaceutiska produkter. Den appliceras på den inflammerade huden i form av damm eller lotion.
I veterinärapplikationer
Znco3 Det fungerar som ett sammandragande, antiseptiskt och aktuellt skydd av djur i djur.
Det gör det också möjligt att förhindra sjukdomar orsakade av zinkbrist, så det används som ett tillägg i kosten för vissa djur, förutsatt att de administrerade mängderna ligger inom de normer som fastställts av hälsobyråer.
 Zinkkarbonat administreras ibland som ett mikronäringsämne för att undvika sjukdomar hos grisar. Okänd författare / CC0. Källa: Wikimedia Commons.
Zinkkarbonat administreras ibland som ett mikronäringsämne för att undvika sjukdomar hos grisar. Okänd författare / CC0. Källa: Wikimedia Commons. I porcheratosutbrott hos grisar läggs det till i kosten för dessa. Denna sjukdom är en förändring av huden där hornhinneskiktet inte bildas korrekt.
Som flamskyddsmedel
Det används som brandsäker fyllning för gummi och plast som utsätts för höga temperaturer. Låter dig skydda textilfibrer från eld.
När det gäller bomullstextilier appliceras det på tyget tillsammans med några alkali. Detta attackerar direkt primära hydroxylgrupper (-ch2OH) av cellulosa och gör dem till sodiocellulosa (-ch2PÅ EN).
Brottet av cellulosaförbindelser från alkali gynnar större penetrabilitet hos kedjorna i den kompakta cellulosa strukturen, så att mer ZnCO -kvantitet3 lyckas komma in i den amorfa zonen i detta och dess spridning underlättas.
Kan tjäna dig: Vanadium: Historia, Egenskaper, struktur, användningar Vissa bomullstyger kan innehålla Znco3 i sina fibrer för att göra dem motståndskraftiga mot eld. Socken_farbig.JPEG: Scott Bauerivative Work: Sock / Public Domain. Källa: Wikimedia Commons.
Vissa bomullstyger kan innehålla Znco3 i sina fibrer för att göra dem motståndskraftiga mot eld. Socken_farbig.JPEG: Scott Bauerivative Work: Sock / Public Domain. Källa: Wikimedia Commons. Som ett resultat av detta reduceras mängden brandfarlig gas som kan uppstå med eld.
I tandbehandlingar
Vissa tandkrämer baserade på zinkkarbonat -nanokristaller och hydroxyapatit appliceras regelbundet för att protesera överkänslighet mer effektivt än de baserade på fluorid.
Nanokristallerna i Znco3 och hydroxiapatit har en storlek, form, kemisk sammansättning och kristallinitet som liknar den för dentinet, så att dentinala tubuli kan stängas med applicering av dessa material.
 Znco -nanopartiklar3-Hydroxiapathite har testats framgångsrikt för att minska känsligheten i blekta tänder. Författare: Fotoblandning. Källa: Pixabay.
Znco -nanopartiklar3-Hydroxiapathite har testats framgångsrikt för att minska känsligheten i blekta tänder. Författare: Fotoblandning. Källa: Pixabay. Denna typ av tandläkare var användbara efter tandblekningsprocesser.
För att separera farliga arsenikmineraler
Arseniska mineralmetoder för svavelbergarter (såsom galena, chalcopyrite och pyrit) har testats med ZnCO)3. Malmen i arsenik måste separeras från andra eftersom detta element är ett mycket giftigt och giftigt förorenande för levande varelser.
För att uppnå detta behandlas blandningen av markbergarter med en zinksulfatlösning och natriumkarbonat till ett pH av 7,5-9,0 och en xantatförening.
 Arsenopirita. Detta mineral bör separeras från andra eftersom den innehåller arsenik giftig. Separation kan uppnås med zinkkarbonat. James St. John/CC av (https: // Creativecommons.Org/licenser/av/2.0). Källa: Wikimedia Commons.
Arsenopirita. Detta mineral bör separeras från andra eftersom den innehåller arsenik giftig. Separation kan uppnås med zinkkarbonat. James St. John/CC av (https: // Creativecommons.Org/licenser/av/2.0). Källa: Wikimedia Commons. Formelns effektivitet tillskrivs bildandet av små ZnCO -partiklar3 På ytan av arsenopyriten vilket gör den hydrofil (relaterad till vatten), så att du inte kan följa luftbubblor och inte kan flyta, utfällning och separera från de andra mineralerna.
För att få andra zinkföreningar
Zinkkarbonat har använts för att erhålla hydrofoba nanostrukturer av Borate of Formel 3Zno • 3B2ANTINGEN3• 3,5H2ANTINGEN. Detta material kan användas som ett flamskyddsmedelstillsats i polymerer, trä och textilier.
Vid återvinning av zink av återstående avloppsvatten
Rika syntetiska vatten på zinkjoner kasserade genom elektrodepositionsprocesser kan behandlas med fluidiserad sängteknologi med natriumkarbonat för att fälla ut Znco3.
Kan tjäna dig: Sekundär alkohol: Vad är, struktur, egenskaper, användningarNär Zn fälls ut2+ I form av karbonat minskar dess koncentration, filtreras det fasta fasta ämnet och vattnet kan kasseras säkert. Znco3 fällning är hög renhet.
Andra appar
Gör det möjligt att förbereda andra zinkföreningar. Det används i kosmetika. Det fungerar som ett pigment och används vid tillverkning av porslin, keramik och keramik.
Risker
Znco damminandning3 Det kan orsaka avgörande, hosta, bröst, feber och svettande obehag. Dess intag producerar illamående och kräkningar.
Effekter på miljön
Huvudrisken är dess effekt på miljön, så det bör undvikas att spridas i detta. Det är mycket giftigt för vattenlevande liv med konsekvenser som varar i levande organismer.
Referenser
- ELLER.S. National Library of Medicine. (2019). Zinkkarbonat. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Bly, D.R. (redaktör) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Sharma, V. et al. (2018). Syntes av zinkkarbonat nanonedlar, till potentiellt flamskyddsmedel för bomullstextiler. Cellulosa 25, 6191-6205 (2018). Länk återhämtat sig.Kandare.com.
- Guan och. et al. (2020). Kolloidal ZnCO3 som ett kraftfullt depressiv av arsenopyrit i svagt alkalisk massa och interaktionsmekanismen. Mineraler 2020, 10, 315. MDPI återhämtade sig.com.
- Sjukdomar i huden, ögat, konjunktiva och yttre örat. (2017). I veterinärmedicin (elfte upplagan). Återhämtat sig från Scientedirect.com.
- Hannig, m. och Hannig, c. (2013). Nanobiomaterial i förebyggande tandvård. I nanobiomaterial i klinisk tandvård. Kapitel 8. Återhämtat sig från Scientedirect.com.
- Tugrul, n. et al. (2015). Syntes av hydrofoba nanostrukturer zink borrerar från zinkkarbonat och karakterisering av produkten. Res Chem Intermediate (2015) 41: 4395-4403. Länk återhämtat sig.Kandare.com.
- Luna, m.D.G., et al. (2020). Återvinning av zinkgranuler från syntetiskt elektroplätering av avloppsvatten med hjälp av fluidiserad-KED-homogen kristallisationsprocess. Int. J. Miljö. Sci. Teknol. 17, 129-142 (2020). Länk återhämtat sig.Kandare.com.
- « Speciella och universella förslag egenskaper
- Vad är den ekonomiska processen? Stadier och exempel »

