Borsyrakemisk struktur, egenskaper, beredning, användningar

- 4885
- 1157
- Per Eriksson
han borsyra Det är en oorganisk förening vars kemiska formel är h3Bo3. Den består av ett vitt eller färglöst fast ämne. Det är en svag syra som i vattenlösning producerar, beroende på dess koncentration, ett pH mellan 3,8 och 4,8. Det är lite lösligt i kallt och måttligt lösligt varmt vatten.
Borsyran upptäcktes 1702 av Wilhelm Man.
 Fast prov av borsyra på klockglas. Källa: Walkerma via Wikipedia.
Fast prov av borsyra på klockglas. Källa: Walkerma via Wikipedia. Det påpekas emellertid också att Boerg beredde borsyran genom att tillsätta vatten till boraxen och värma lösningen för att avdunsta den och därmed lämna i sedimentet kryalsyran kristaller.
Denna syra är en mycket användbar förening som har många tillämpningar inom industri och medicin, som också används som insektsmedel, bevarande av trä, fördröjd eld och är en beståndsdel av en pH -dämpningslösning.
[TOC]
Kemisk struktur
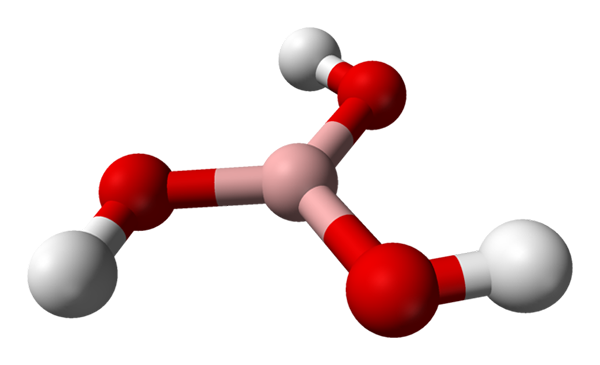 Borsyramolekylen representerad av en sfärer och staplarmodell. Källa: Benjah-Bmm27 [Public Domain]
Borsyramolekylen representerad av en sfärer och staplarmodell. Källa: Benjah-Bmm27 [Public Domain] I den överlägsna bilden har vi själva molekylen i H3Bo3. Observera att väteatomer, representerade av vita sfärer, inte är kopplade till den centrala boratomen, vilket kan antyda den kemiska formeln; utan snarare till syreatomer, representerade av röda sfärer.
Således är en mer bekväm formel, även om det är mindre använt, för borsyra B (OH)3, indikerar att deras surhet beror på hjoner+ Befriad från sina OH -grupper. Molecula B (OH)3 Den har en trigonal platt geometri, med sin boratom som har en kemisk hybridisering SP2.
B (OH)3 Det är en kovalent högmolekyl, eftersom skillnaden i elektronegativitet mellan boratomen och syre inte är särskilt stor; Så B-O-länkarna är i huvudsak kovalenta. Observera att strukturen för denna molekyl liknar en spinner. Kan jag slå på din egen axel på samma sätt?
Kristaller
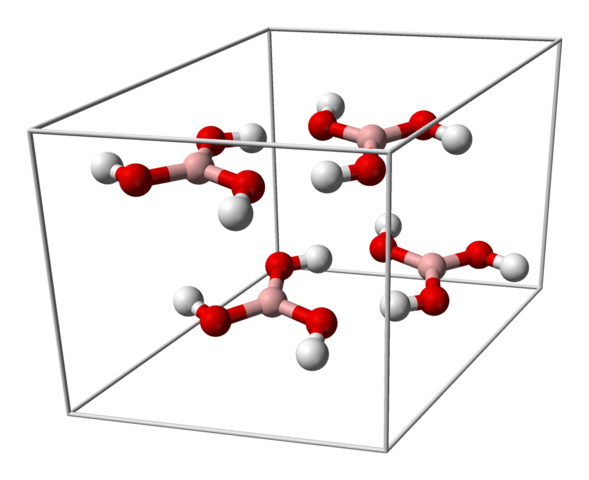 Enhetscell för H3BO3 -kristall. Källa: Benjah-Bmm27 [Public Domain]
Enhetscell för H3BO3 -kristall. Källa: Benjah-Bmm27 [Public Domain] Den övre bilden visar den enhetliga cellen som motsvarar den tricering kristallina strukturen för borsyra som under vissa syntesförhållanden kan anta den kompakta hexagonala strukturen. Observera att det finns fyra molekyler per enhetscell, och som beställs i två lager, A och B, växlade (de är inte överlagrade ovanpå varandra).
På grund av symmetri och vägledning av B-OH-länkar kan det antas att B (OH)3 Det är apolärt; Förekomsten av intermolekylära vätebroar förändrar emellertid historien. Varje B (OH) molekyl3 att ge eller ta emot tre av dessa broar, med totalt sex dipol-dipolo-interaktioner, till exempel de som observerats i bilden nedan:
Kan tjäna dig: terpenos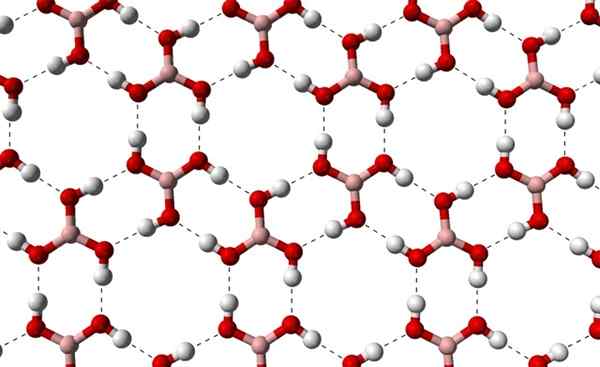 Kristallina skikt av H3BO3 observerade från en högre axel. Källa: Benjah-Bmm27 [Public Domain]
Kristallina skikt av H3BO3 observerade från en högre axel. Källa: Benjah-Bmm27 [Public Domain] Observera att dessa vätebroar är de riktningsinteraktioner som styr borsyrakristaller och upprättar mönster av prydnadsaspekter; Interna ringar kanske med tillräckligt med utrymme för att tilltäppa vissa föroreningar som inte finns i kristallina defekter.
Dessa vätebroar, trots den låga molekylmassan av B (OH)3, De håller sitt glas sammanhängande för att han behöver en temperatur på 171 ºC för att smälta. Det är okänt vilka effekter som skulle ha höga tryck (i ordningen av GPA) på molekylskikten av B (OH)3.
Egenskaper
Namn
IUPAC: Borsyra och trihydrooxidobor. Andra namn: Orthoboric Acid, Borracic Acid, Sassolite, Borofax och Trihydroxiborano.
Molmassa
61,83 g/mol
Fysiskt utseende
Kristallin, färglös och transparent vitt fast ämne. Det uppnås också som granuler eller i form av vitt damm. Lite otrevligt att röra.
Lukt
Toalett
Smak
Lite bitter
Smältpunkt
170,9 ºC
Kokpunkt
300 ºC
Vattenlöslighet
Måttligt lösligt i kallt och lösligt vatten i varmt vatten:
2,52 g/100 ml (0 ºC)
27,50 g/100 ml (100 ºC)
Borsyra är delvis löslig i vatten och tenderar att sjunka in i den. Denna löslighet tenderar att öka i närvaron av syror, såsom vattenklor, citron och tartarisk.
Löslighet i andra lösningsmedel
-Glycerol: 17,5 % vid 25 ° C
-Etylenglykol: 18,5 % vid 25 ° C
-Aceton: 0,6 % vid 25 ° C
-Etylacetat: 1,5 % vid 25 ° C
-Metanol: 172 g/l a 25 ºC
-Etanol: 94,4 g/l a 25 ºC
Oktanol/vattenpartitionskoefficient
Log P = -0.29
Aciditet (PKA)
9.24. 12.4. 13.3. Dessa är de tre konstanterna i deras respektive dissociationer för att frigöra h+ I vatten.
pH
3,8 - 4,8 (3,3 % i vattenlösning)
5.1 (0,1 molar)
Ångtryck
1,6 · 10-6 mmhg
Stabilitet
Stall i vatten
Sönderfall
Den bryts ned när den värms upp över 100 ºC och bildar borhydrid och vatten.
Reaktivitet
Borsyra bildar lösliga salter med monovalenta katjoner, till exempel: NA2B4ANTINGEN7.10 timmar2Eller, och olösliga salter med divalent katjoner, hytt4ANTINGEN7.6h2ANTINGEN.
I vattenlösning producerar den en syralösning och tänker att denna egenskap berodde på subtraktionen av OH -grupper- av vattnet. Borsyran är kvalificerad som en svag syra av Lewis -typen.
Borsyran reagerar med glycerol och mannitol, vilket ökar surheten i den vattenhaltiga miljön. PKA modifieras från 9,2 till 5 på grund av bildandet av Boro-Manitol Quelato [BC6H8ANTINGEN2(ÅH)2]-, som släpper h+.
Förberedelse
Borsyra är i fritt tillstånd i vulkaniska utsläpp i regioner som Toscana i Italien, Lipariöarna och i delstaten Nevada, USA. Det finns också i mineraler som Borax, Boracita, Ulexita och Colemanita.
Kan tjäna dig: halogenerBorsyran framställs huvudsakligen genom reaktionen av boraxmineralet (natriumnatriumtetreboryr) med mineralsyror, såsom saltsyra, svavelsyra, etc.
Na2B4ANTINGEN9· 10 timmar2O +hcl => 4 h3Bo3 + 2 NaCl +5 h2ANTINGEN
Det är också beredd genom hydrolysen av Boro och Diborano Trihaluro.
Borsyra framställs från Collemanite (CA2B6ANTINGENelva· 6 h2ANTINGEN). Förfarandet består i behandlingen av mineral med svavelsyra för att lösa borföreningar.
Sedan separeras lösningen där borsyran i de oundvikliga fragmenten är närvarande. Vätesulfidlösningen behandlas för att fälla ut föroreningarna hos arsenik och järn. Supernatanten kyls för att producera en fällning av borsyra och separera den från suspensionen.
Ansökningar
Inom industrin
Borsyran används i glasfiberutarbetning. Genom att bidra till att minska smältpunkten ökar det styrkan och effektiviteten för textilfiberglas: material som används för att förstärka plasten som används i kärl, industridör och datorkretsar plattor.
Borsyran deltar i tillverkningen av borosiliserat glas, som gör det möjligt att få ett glasbeständigt glas, användbart i hushållsköket, i glasmaterialet av laboratorier, fluorescerande rör, fiberoptik, LCD -skärmar, etc.
Det används i den metallurgiska industrin för att härda och behandla stållegeringar, samt gynna materialets metallfoder.
Det används som en kemisk komponent i hydraulisk frakturering (fracking): Metod som används i olje- och gasutvinning. Borsyran fungerar som ett brandhämmande medel i cellulosamaterial, plast och textilier som är impregnerade med borsyra för att öka deras brandmotstånd.
Inom medicin
Borsyra används utspädd i ögontvätt. Borsyragelatinkapslar används för behandling av svampinfektioner, särskilt Candida albicans. Det har också använts vid behandling av akne.
Borsyran är strö i strumpor för att förhindra fötterinfektioner, till exempel idrottsman fot. På samma sätt används lösningar som innehåller borsyra vid behandling av yttre otit hos människor, liksom hos djur.
Borsyra tillsätts i flaskorna som används för urinuppsamling, vilket förhindrar bakteriell förorening innan de undersöks i diagnostiska laboratorier.
Det kan tjäna dig: Indolaletic Acid: Structure, Egenskaper, erhållning, användningInsekticid
Borsyra används vid kontroll av insektsproliferation, såsom kackerlackor, termiter, myror, etc. Kackerlackorna dödar inte direkt, eftersom den först påverkar dess matsmältnings- och nervsystem, förutom att förstöra dess exoskeleton.
Borsyran utövar sin handling långsamt, vilket gör att insekter har intagit den att komma i kontakt med andra insekter och därmed sprida förgiftning.
Bevarande
Borsyran används för att förhindra attack av trä av svampar och insekter, använder för detta ändamål i samband med etylenglykol. Denna behandling är också effektiv vid kontroll av silt och alger.
PH -stötdämpare
Borsyra och dess konjugerade bas bildar ett PKA -dämpningssystem = 9,24, vilket indikerar att denna stötdämpare har sin största effektivitet för alkaliskt pH, som inte är vanligt i levande varelser. Borato -stötdämpare används emellertid i pH -reglering i pooler.
Kärnreaktorer
Borsyra har förmågan att fånga termiska neutroner, vilket minskar möjligheten till icke -kontrollerad kärnklyvning som kan ge kärnkraftsolyckor.
Lantbruk
Boro är ett väsentligt element för växttillväxt, som inducerade användningen av borsyra för elementets bidrag. I överskott av borsyra kan emellertid skada växter, särskilt citrusfrukter.
Kontraindikationer
Användningen av borsyra på den denudderade huden, sår- eller bränningsprodukten som tillåter absorption av samma måste undvikas. Detta är en toxisk förening i kroppen och i vissa fall kan det orsaka besvimning, kramper, spasmer, ansiktsuppgifter och arteriell hypotension.
Läkaren bör konsulteras för användning av vaginalkapslar i borsyran hos gravida kvinnor, eftersom det har påpekats att fosterdeformationer och en minskning av barnets kroppsvikt vid födseln kan producera vid födseln.
Placering av borsyra, som används som insektsmedel, på platser som är tillgängliga för barn, eftersom barn har en större mottaglighet för den toxiska verkan av borsyra, som i dem etablerar den dödliga dosen i 2.000 till 3.000 mg.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2019). BORSYRA. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). BORSYRA. Pubchemdatabas. CID = 7628. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Redaktörerna för Enyclopaedia Britannica. (28 mars 2019). BORSYRA. Encyclopædia Britannica. Återhämtat sig från: Britannica.com
- Bärande bärare. (9 november 2018). De dolda USSE: erna i Buric Acid i ditt dagliga liv. Återhämtat sig från: bärvibrering.com
- National Pesticide Information Center. (s.F.). BORSYRA. Återhämtat sig från: npic.Orst.Edu
- Utarbetande. (30 november 2017). Borsyra: egenskaper och användningar av denna kemiska förening. Hämtad från: syror.Info
- Klorurosodium. (2019). Borsyra. Återhämtat sig från: klorurosodium.com
- Spanska samhället i sjukhusapotek. (s.F.). Borsyra. [Pdf]. Hämtad från: grupper av arbete.Sefh.är
- « Optisk komparator vad är användningen av och delar
- 11 fördelar med återvinning i samhället (med exempel) »

