Fosforsyra (H3PO4)
- 1032
- 290
- Per Eriksson
 Individuell fosforsyramolekyl
Individuell fosforsyramolekyl Vad är fosforsyra?
han fosforsyra Det är en oxo -syra i fosfor som har en kemisk formel h3Po4. Den består av en mineralsyra där tre syraprotoner är kopplade till fosfatanjonen (PO43-). Även om det inte betraktas som en stark syra, kan dess olämpliga användning ha en hälsorisk.
Det finns i två tillstånd: som ett fast ämne i form av tjocka ortorrombiska kristaller, eller som en kristallin sirap -ser vätska. Dess vanligaste kommersiella presentation har en koncentration av 85% P/P och en densitet av 1 685 g/cm3. Denna densitet kommer från koncentrationens hand.
De tre OH -grupperna är ansvariga för att donera syrahydrogener. På grund av deras närvaro i deras struktur kan du reagera med olika hydroxider som orsakar flera salter.
När det gäller natriumhydroxid kan du bilda tre: monobasiskt natriumfosfat (NAH2Po4), Dibasic Natriumfosfat (NA2Hpo4) och tribasiskt natriumfosfat (NA3Po4).
Beroende på vilken bas som används för neutralisering, eller vilka katjoner som är mycket nära den, kan du bilda andra fosfatsalter. Bland dem är: Kalciumfosfat (CA3(PO4)2), Litiumfosfat (LI3Po4), järnfosfat (FEPO4), och andra. Var och en med sina olika grader av protonering av fosfatanjonen.
Å andra sidan kan fosforsyran "kidnappa" divala katjoner som tro2+, Cu2+, Växelström2+ och mg2+. Vid höga temperaturer kan du reagera med dig själv med förlusten av en H -molekyl2Eller bildande diametrar, trimmer och polymerer av fosforsyror.
Denna typ av reaktion gör att denna förening kan etablera ett stort antal strukturer med fosfor- och syreskelett, från vilka ett brett utbud av kända salter också kan erhållas, såsom polyfosfater.
När det gäller sin upptäckt syntetiserades han 1694 av Robert Boyle (1627-1691), och upplöses P2ANTINGEN5 (Fosfor pentoxid) i vatten. Det är en av de mest användbara mineralsyrorna, som är dess funktion som gödselmedel den viktigaste.
Fosfor, kalium och kväve utgör de tre huvudsakliga näringsämnena i växter.
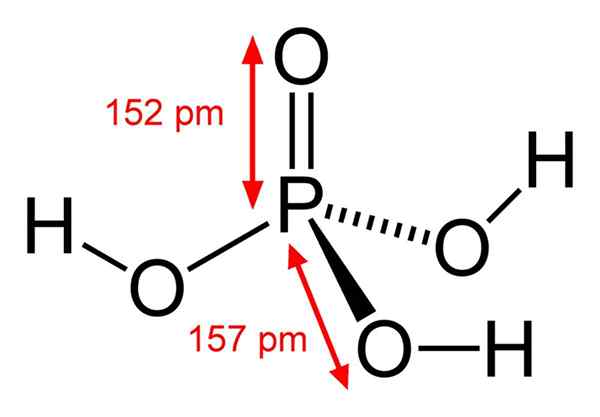
Kemisk fosforsyrastruktur
 Kemisk fosforsyrastruktur
Kemisk fosforsyrastruktur Fosforsyran består av en p = O -bindning. Med fosforatomen i mitten ritar syre en slags molekylär tetrahedron.
På detta sätt kan fosforsyra visualiseras som en tetrahedron. Ur detta perspektiv dessa tetrahedra (av H -enheter3Po4) interagera med varandra med vätebroar; det vill säga deras vertikaler närmar sig nära.
Dessa intermolekylära interaktioner tillåter fosforsyrakristall i två fasta ämnen: vattenfri och hemihydrat (H3Po4· 1/2h2O), båda med monokliniska kristallina system. Dess anhydraform kan också beskrivas med formeln: 3h2Eller · p2ANTINGEN5, vilket är lika med en tri-hydratiserad fosforpentoxid.
Tetrahedra kan till och med länka kovalent, men för detta måste en av dess enheter eliminera en vattenmolekyl genom uttorkning. Detta inträffar när h3Po4 Den genomgår uppvärmning och genererar som en följd bildningen av polyfosfäriska syror (PA).
Diposforsyra (h4P2ANTINGEN7)
Det enklaste av allt PA är diposforsyra (h4P2ANTINGEN7), även känd som pyrofosforsyra. Den kemiska ekvationen för din bildning är som följer:
Det kan tjäna dig: aluminiumfosfat (Alpo4): Struktur, egenskaper, erhållning, användning2h3Po4 H4P2ANTINGEN7 + H2ANTINGEN
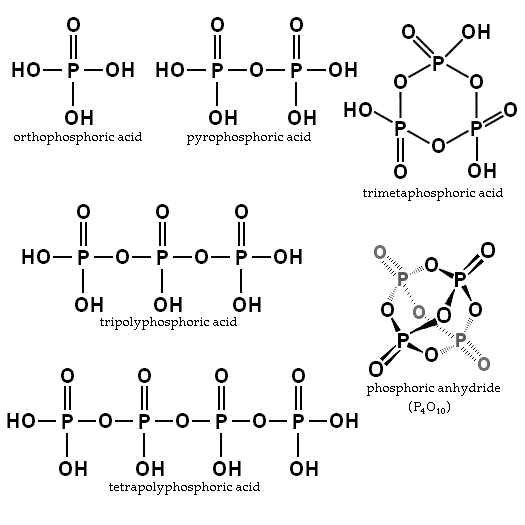
Balansen beror på mängden vatten och temperatur. Vad är dess struktur? I bilden av sektionen illustreras strukturerna för ortofosfahiska och pyrofosforsyra i det övre vänstra hörnet.
Två enheter går samman kovalent när en vattenmolekyl elimineras och bildar en P-O-P syrebro mellan dem. Nu är de inte tre sura väte, men fyra (fyra grupper -OH). På grund av detta, h4P2ANTINGEN7 presenterar fyra K -konstanter Ktill.
Polyfosforsyror
Dehydrering kan fortsätta med pyrofosforsyra om uppvärmningen fortsätter. Därför att? Eftersom i varje ände av sin molekyl finns en OH-grupp som kan elimineras som en vattenmolekyl, vilket främjar den efterföljande tillväxten av P-O-O-O-P-skelettet ... P ..
Exempel på dessa syror är trimfosforiska och tetropolifforinsyror (båda illustrerade också i föregående bild). Det kan ses hur P-O-P-skelettet förlängs i en slags kedja som bildas av Tetrahedra.
Dessa föreningar kan representeras med HO -formeln (PO2ÅH)xH, där ho är den vänstra änden som kan dehydrera. Po2OH är fosforskelettet med P = O- och OH -länkarna; Och x är fosforsyranheter eller molekyler som är nödvändiga för att få nämnda kedja.
När dessa föreningar är helt neutraliserade, har de så kallade polyfosfaterna sitt ursprung. Beroende på vilka katjoner de är omgivna bildar de en mängd olika polyfosfatsalter.
Å andra sidan, om de reagerar med ROH -alkoholer, ersätts hydrogener på deras skelett av alkylsubstituenterna R-. Således uppstår fosfatestrar (eller polyfys): RO (PO2Eller)xR. Det räcker för att ersätta H med alla strukturerna i bilden av sektionen för att få dem.
Cykliska polyfosforsyror
P-O-P-kedjor kan till och med stängas i en ring- eller fosforcykel. Den enklaste av denna typ av förening är trimetafosforsyra (det övre högra hörnet av bilden). Således kan PA vara linjär, cyklisk; eller om deras strukturer uppvisar båda typerna, grenade.
Nomenklatur
 Fosforsyra. Källa: Commons.Wikimedia.org
Fosforsyra. Källa: Commons.Wikimedia.org Nomenklaturen för fosforsyra styrs av IUPAC och hur nullionssalterna av oxoacider heter.
För i h3Po4 Atomen i P har Valencia +5, den med det största värdet, dess syra tilldelas suffixet -ico till fosforprefixet-.
Orto-
Fosforsyra berättas emellertid också ofta ortofosforsyra. Därför att? Eftersom ordet "orto" är grekisk och betyder "sant"; vilket skulle resultera i den "sanna formen" eller "mer hydratiserad" av samma.
När den fosforhydro är hydratiserad med ett överskott av vatten (P4ANTINGEN10, "Superior Image" Cap ")3Po4 (3h2Eller · p2ANTINGEN5). Således tilldelas orto -prefixet till de syror som bildas med rikligt med vatten.
Piro-
Piro-prefixet hänvisar till varje förening som har sitt ursprung efter applicering av värme, eftersom diposforsyran uppstår från den termiska uttorkningen av fosforsyran. Det kallas därför pyrofosforsyra (2H2Eller · p2ANTINGEN5).
Mål-
Målprefixet, som också är ett grekiskt ord, betyder "efter". Det läggs till de ämnen vars formel har eliminerat en molekyl, i detta fall, vatten:
H3Po4 => Hpo3 + H2ANTINGEN
Observera att den här gången tillägg av två fosforenheter inte inträffar för att bilda diposforsyran, men istället för metafosforsyran erhålls (från vilken det inte finns några bevis på dess existens).
Kan tjäna dig: etylalkohol: struktur, egenskaper, användningar, erhållningDet är också viktigt att lyfta fram att denna syra kan beskrivas som h2Eller · p2ANTINGEN5 (Liknar hemidrat, multiplicerar HPO3 För 2). Prefixmeta- är perfekt enligt den cykliska PAS, eftersom om trfosforsyran blir uttorkad, men lägger inte till en annan enhet H3Po4 För att bli tetrafosforsyra måste du bilda en ring.
Och detta är samma sak med andra polymeetofosforsyror, även om IUPAC rekommenderar att han kallar dem som cykliska föreningar av motsvarande PA.
Fosforsyraegenskaper
Molekylär formel
H3Po4
Molekylvikt
97 994 g/mol
Fysiskt utseende
I sin fasta form presenterar den ortorrombisk, hygroskopisk och transparenta kristaller. I den flytande formen är det kristallint, med ett visköst siraputseende.
Kommersiellt uppnås det i vattenlösning med en koncentration av 85% p/p. I alla dessa presentationer saknar det lukt.
Kokning och fusionspunkter
158º C (316º F A 760 mmHg).
108º F (42,2º C).
Vattenlöslighet
548 g/100 g h2Eller 20 ° C; 369,4 g/100 ml vid 0,5 ° C; 446 g/100 m vid 14,95 ° C.
Densitet
1 892 g/cm3 (fast); 1 841 g/cm3 (100%lösning); 1 685 g/cm3 (85%lösning); 1 334 g/cm3 50%lösning) vid 25 ° C.
Ångtäthet
Luftrelativ 3.4 (luft = 1).
Självtändning
Det är inte brandfarligt.
Gegga
3,86 mpoise (40% till 20 ° C).
Aciditet
PH: 1,5 (0,1 N -lösning i vatten)
PKA: PKA1 = 2 148; PKA2 = 7,198 och PKA3 = 12,319. Därför är dess mest sura väte det första.
Sönderfall
När han är uppvärmd släpper han fosforoxider. Om temperaturen stiger till 213 ° C eller mer blir den pyrofosforsyra (h4P2ANTINGEN7).
Korrosivitet
Frätande för järnmetaller och aluminium. När man reagerar med dessa metaller har väteförbränningsbar gas härstammar från.
Polymerisation
Våldsamt polymeriza med hoaxföreningar, epoxider och polymeriserbara föreningar.
Fosforsyraanvändningar
Fosfat och allmän användning försäljning
-Fosforsyra fungerar som grund för fosfatutarbetande, som används som gödselmedel eftersom fosfor är ett huvudsakligt näringsämne av växter.
-Det har använts vid behandling av ledande förgiftning och andra förhållanden där viktiga fosfatmängder och produktion av mild acidos krävs.
-Det används för att styra urinvägens pH för minks och katter för att undvika bildning av njurberäkningar.
-Fosforsyra orsakar Na -salter2Hpo4 och nah2Po4 som utgör ett pH -stötdämpare -system med en PKA på 6,8. Detta pH -regleringssystem finns i människor, med betydelse i regleringen av intracellulärt pH, liksom i hanteringen av vätekoncentration i nefronens distala och samlarrör.
-Det används vid eliminering av Mohosa -skiktet av järnoxid som ackumuleras på denna metall. Fosforsyra bildar järnfosfat, som lätt kan tas bort från metallytan. Det används också i aluminium elektriska polska.
Industriister
-Fosforsyra är avsedd som ett katalytiskt medel i utarbetandet av nylon och bensin. Det används som ett dehydratiseringsmedel i den litografiska graveringen, i utarbetandet av färgämnen för användning i textilindustrin, i processen för koagulering av latexen i strandindustrin och i rening av väteperoxid (väteperoxid (väteperoxid).
-Syra används som ett tillsatsmedel i läskedrycker som bidrar på detta sätt till dess smak. Utspädd, den appliceras i sockerförfineringsprocessen. Det fungerar också som ett stötdämpare -system i framställningen av skinka, gelatin och antibiotika.
Kan tjäna dig: aluminiumhydroxid: struktur, egenskaper, användningar, risker-Ingriper i utarbetandet av tvättmedel, i syrakatalysen av acetylenproduktion.
-Det används som en sura i balanserade livsmedel för boskapsindustrin och husdjur. Läkemedelsindustrin använder den vid tillverkning av antiemetikmediciner. Det drar också nytta av en blandning för att göra asfalt för att bana marken och reparera sprickor.
-Fosforsyran fungerar som en katalysator i hydreringsreaktionen hos alkener för att producera alkohol, främst etanol. Dessutom används det vid bestämning av organiskt kol i jordar.
Dental
Det används av tandläkare för att rengöra och konditionera tandytan före placering av tandstöd. Den hittar också användning vid tandblekning och eliminering av tandplattor. Dessutom används det vid tillverkning av lim för tandproteser.
Kosmetika
Fosforsyra används för att justera pH i utarbetandet av kosmetiska produkter och för hudvård. Det används som ett kemiskt oxidationsmedel för produktion av aktivt kol.
Fosforsyrabildning
-Fosforsyra framställs från fosfatbergarter av apatit, med hjälp av dess koncentrerade svavelsyra -matsmältning:
Växelström3(PO4)2 + 3 h2Sw4 + 6 h2O => 2 h3Po4 + 3 (fall4.2h2ANTINGEN)
Den fosforsyran som erhålls i denna reaktion är låg renhet, så den genomgår en reningsprocess som inkluderar nederbörd, lösningsmedel extraktion, kristallisation och jonbytningstekniker.
-Fosforsyra kan uppstå genom att lösa fosforpentoxid i kokande vatten.
-Det kan också erhållas genom att värma fosfor med en blandning av luft och vattenånga:
P4 (l) +5 o2 (g) => p4ANTINGEN10 (S)
P4ANTINGEN10 (s) +h2Eller (g) => 4h3Po4 (L)
Risker
-Eftersom ditt ångtryck är lågt vid rumstemperatur är det osannolikt att dina ångor kan inhaleras, såvida inte syran sprayas. I så fall inkluderar symtomen på deras inandning: hosta, ont i halsen, kortlivad och mödosam andning.
-I litteraturen citeras fallet med en sjöman som utsattes för fosforsyravångor under en lång tidsperiod. Lidit allmän svaghet, torr hosta, bröstsmärta och andningsproblem. Efter ett år efter utställningen observerades en reaktiv dysfunktion av luftvägarna.
-Kutan kontakt med fosforsyra kan orsaka rodnad, smärta, blåsor och hudförbränningar.
-Syrans kontakt med ögonen, beroende på dess koncentration och varaktigheten på kontakten, kan producera i dessa, vävnad frätande lesioner eller allvarliga brännskador med permanent okulär skada.
-Syra intag orsakar brännskador i munnen och halsen, eldkänsla utöver bröstbenet, abdominalsmärta, kräkningar, chock och kollaps.
Referenser
- Royal Society of Chemistry. (2015). Fosforsyra. Taget från: chemspider.com
- Kanadensiska hälso- och arbetssäkerhetscentrum. (1999). Fosforsyra - Hälsoeffekter. Taget från: CCSSO.Växelström
- Syror.Info. (2018). Fosforsyra "Variation av användningar av denna kemiska förening. Taget från: syror.Info
- James P. Smith, Walter E. Brown och James R. Leva. (1955). Kristallin fosforsyra. J. A.M. Kem. Soc. 77, 10, 2728-2730
- Wikipedia. (2018). Fosforsyror och fosfater. Taget från: i.Wikipedia.org
- Vetenskap är kul. Lär dig mer om fosforsyra. [Pdf]. Taget från: Scifun.Kem.Vagga.Edu

