Kinetisk enzym
- 5008
- 807
- Karl Johansson
Vad är enzymatisk kinetik?
De Kinetisk enzym Det är ett studieområde där fysikalisk och biokemi möts för att studera kemiska reaktioner katalyserade av enzymer. Enzymer är biologiska katalysatorer som ökar hastigheten på en kemisk reaktion genom att minska deras aktiveringsenergi.
Enzymer katalyserar kemiska reaktioner av stor betydelse för att upprätthålla liv. De har både ett pH och en optimal temperatur för att utöva sin katalytiska verkan på underlaget, så de är väsentliga faktorer i studien av sin verksamhet.
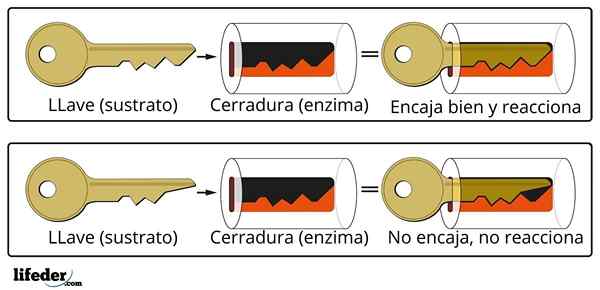
 Det nyckelstängande systemet är en ungefärlig analogi till substrat-enzymsystemet.
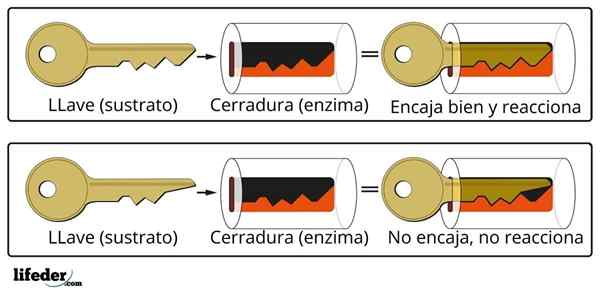
Det nyckelstängande systemet är en ungefärlig analogi till substrat-enzymsystemet. Enzymet interagerar med substratet genom en specialiserad region i dess proteinkedja, som kallas ett aktivt centrum, vars tre dimensionella struktur är kopplad till substratstrukturen. Interaktionen mellan det aktiva centrumet och underlaget är vanligtvis svag och inte kovalent.
Antalet aktiva enzymcentra är begränsat och producerar dess mättnad med substratmolekyler, vilket i sin tur förhindrar att reaktionens hastighet ökar utöver ett visst värde, kallad maximal hastighet.
Enzymatisk kinetik kombinerar inte bara biokemi och fysikalisk, utan också bioinorganisk, supramolekylär kemi, beräkningskemi och statistik.
Bland modellerna som beskriver det är det av Michaelis -manc. Idag är det fortfarande en av modellerna som används mest för att beskriva den enzymatiska kinetiken.
Grundläggande begrepp i enzymatisk kinetik
Enzymatisk katalys
Enzymer är proteiner, med katalytiska aktiviteter, som kan agera på en molekyl som kallas substrat, katalyserar dess omvandling till ett annat ämne som kallas produkt. Enzymer konsumeras inte under deras katalytiska verkan, kvarstår sin ständiga massa.
Katalytisk aktivitet
Enzymets katalytiska aktivitet utförs i en specialiserad tre -dimensionell struktur känd som det aktiva centrumet. Detta bildas av vikningen av den enzymatiska proteinkedjan som bestämmer interaktionen mellan en grupp aminosyror som bildar det aktiva centrumet.
Aktivt centrum
Det aktiva centret är inte en styv struktur, men kan geometriskt anpassning till underlaget för att interagera med det. Interaktionen är i allmänhet svag (van der Waals -styrkor), även om det finns enzymer som bildar en kovalent länk till underlaget.
Kan tjäna dig: Butyriskt fett: Att få, typer, komposition, användningar, fördelarMinskad aktiveringsenergi
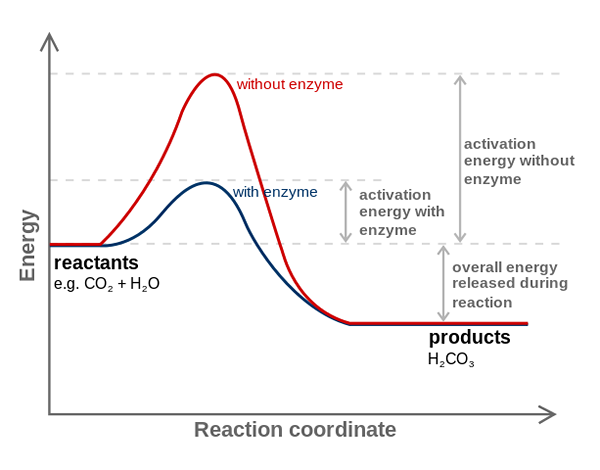 Karbonisk anhydrasenzym minskar aktiveringsenergin för CO2 till H2CO3 -omvandling. Källa: Fvasconcellos (samtal • Bidrag), CC BY-SA 3.0, via Wikimedia Commons
Karbonisk anhydrasenzym minskar aktiveringsenergin för CO2 till H2CO3 -omvandling. Källa: Fvasconcellos (samtal • Bidrag), CC BY-SA 3.0, via Wikimedia Commons Enzymer katalyserar reaktioner som minskar aktiveringsenergin, och därför minskar också fri energiförbrukning (g) som är nödvändig för att slutföra den katalyserade processen. Enzymer modifierar inte jämviktspunkten för icke -katalyserade kemiska reaktioner.
Observera hur kolhydresanhydrasenzym minskar aktiveringsenergin för samverkan2 till H2Co3. Även om avståndet mellan den röda och blåa linjen inte verkar mycket, ökar detta enzym hastigheten i storleksordningen miljoner gånger (106), jämfört med den reaktion som genomfördes utan deras deltagande.
Stereoespecificitet
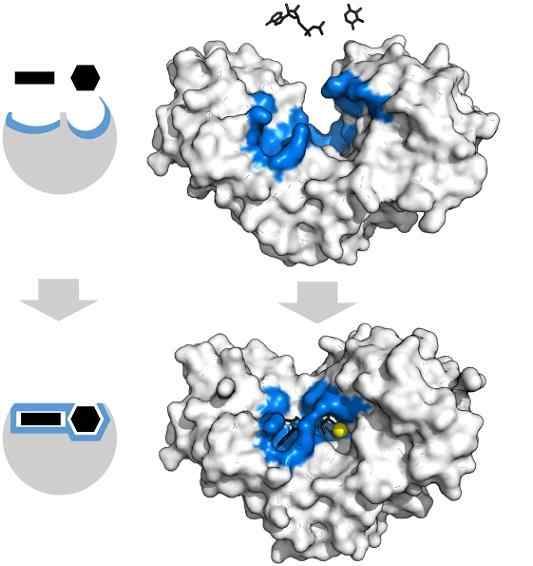 Adenosinsubstrat Tryfosfat och xylos har den specifika formen som sammanfaller med geometri för det aktiva mitten av hexokinasenzymet. Källa: Thomas Shafee, CC av 4.0, via Wikimedia Commons
Adenosinsubstrat Tryfosfat och xylos har den specifika formen som sammanfaller med geometri för det aktiva mitten av hexokinasenzymet. Källa: Thomas Shafee, CC av 4.0, via Wikimedia Commons Enzymer är i allmänhet mycket specifika för de reaktioner de katalyserar, eftersom substratmolekylerna måste interagera med det aktiva centrum som presenterar en uppsättning krav för deras koppling med den.
Således erbjuder det aktiva centrumet för hexokinas, som är dynamisk på grund av molekylära vibrationer av proteinkedjor, grupper i exakta rumsliga orienteringar så att adenosin och xylosadenosinmolekyler, lime upp som om de var bitar som fyllde geometriska.
Den minsta fysiska eller kemiska störningen och det blå -hexokinasregionen kan inte längre rymma underlagen.
Maxhastighet
Enzymer har ett begränsat antal aktiva centra, så genom att öka underlagskoncentrationen. Detta bestämmer att hastigheten på den katalyserade reaktionen inte kan öka utöver ett visst värde, känd som maximal hastighet.
Temperaturkänslighet och pH
Enzymatisk katalytisk aktivitet är beroende av temperatur och pH och har optimala värden på dessa parametrar för dess drift. Eftersom det är enzymernas proteinmolekyler är de mottagliga för en kemisk eller termisk denaturering.
Kofaktorer
Vissa enzymer ökar sin katalytiska aktivitet på grund av påverkan av vissa faktorer, som kan vara metaller eller organiska föreningar som kallas koenzymer.
På samma sätt kan enzymer hämmas konkurrenskraftigt och icke -kompetens. När det gäller hexokinaset uppifrån2+ (gul sfär) fungerar som en kofaktor.
Enzymatisk reaktionshastighet
Hastigheten för en enzymatisk reaktion beror på koncentrationen av substrat och enzymatisk koncentration. När substratkoncentrationen är låg finns det ett nästan linjärt samband mellan enzymatisk hastighet och substratkoncentration.
Det kan tjäna dig: Inga metaller: historia, egenskaper, grupper, användningarDärför ökar enzymatisk hastighet i direkt proportion till substratkoncentration; Men genom att öka koncentrationen av substrat till ett värde som mättar de aktiva platserna för enzymet, uppnås den maximala hastigheten.
När den enzymatiska hastigheten inträffar blir den konstant, det vill säga den är oberoende av substratkoncentrationen och det sägs att enzymatisk hastighet är noll. Dessutom är katalytisk enzymatisk hastighet proportionell mot koncentrationen av enzymsubstratkomplexet [är].
Som det matematiska uttrycket visar:
V = k2[ÄR]
Den maximala hastigheten är direkt proportionell mot den totala koncentrationen av enzymet, som det visas i följande formel:
VMax = KKattOCHt
KKatt Det är rotations- eller ersättningsantalet och representerar antalet substratmolekyler som varje enzymatisk plats omvandlar till en produkt per tidsenhet. Medant representerar antalet katalytiska enzymatiska platser. Jat Det har ett högt värde, ett högre [S] krävs för att mättra de aktiva platserna eller centra.
Michaelis -Mente -ekvation
Modell
Mihaelis -Mente -modellen är baserad på verkan av enzymer som verkar på ett enkelt substrat och inte är tillämpligt på de alosteriska enzymerna; Det vill säga de som har en regleringsregion i den katalytiska aktiviteten på den aktiva platsen.
Enzymer vid en låg koncentration av substrat, har en katalytisk aktivitet som är linjär med koncentrationen av substrat; Men vid höga substratkoncentrationer är katalytisk aktivitet oberoende av substratkoncentration.
1913 föreslog Leonor Michelis och Maud-sinnade en modell för att förklara det enzymatiska beteendet som anges, förekomsten av ett enzym-Sustrato-mellanhandskomplex [är] betydelse i modellen [är].
Allmän ekvation
Förhållandet mellan detta komplex och de andra komponenterna i den enzymatiska processen, liksom med konstanterna (k) som relaterar dem, anges i följande schema:
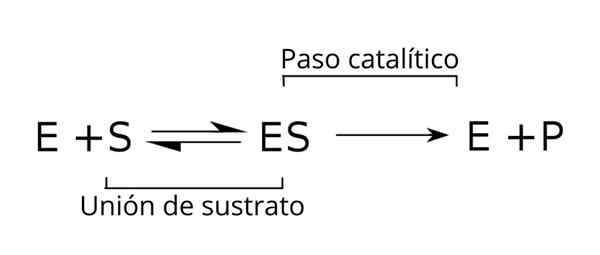 Allmän ekvation av substraten, enzymsubstratkomplexet och produkterna från den enzymatiska kinetiken. Källa: Tim Vickers via Wikipedia.
Allmän ekvation av substraten, enzymsubstratkomplexet och produkterna från den enzymatiska kinetiken. Källa: Tim Vickers via Wikipedia. Enzymet (E) kombineras med substratet (erna) för att bilda enzym-substratkomplexet med en K-hastighetskonstant1. E-S-komplexet kan dissociera i E och S med en reaktionshastighetskonstant K-1.
På samma sätt kan komplexet orsaka en produkt (P) och separationen av enzymet, som kan återvinnas för att möta en annan cykel av enzymatisk aktivitet. En balanssituation kan uppnås för tillståndet [är] där dess bildningshastighet är lika med dess nedbrytningshastighet.
Det kan tjäna dig: naturliga kemiska elementK1[Är] [s] = (k-1 + K2) [Är] (1)
Omgruppering av villkor och rensning [är], har du:
[Är] = ([e] [s]) / (k-1 + K2 / K1) (2)
KM = (K-1 + K2) / K1
KM Det är en konstant introducerad av Michaelis.
Villkor för Michaelis -Mente -ekvationen
Ersätter nu kM I (2) fortsätter vi:
[Är] = [e] [s] / kM (3)
Koncentrationen av icke -kombinerat enzym är:
[E] = [ET] - [es] (4)
Där [e] är det fria enzymet och [eT] Den totala koncentrationen av enzymet.
Kombinera ekvationerna 3 och 4, göra ersättningarna på grund och ta hänsyn till vMax, Michaelis-Muene-ekvation nås, uttryckt på följande sätt:
V = (vMax [S]) / ([s] + kM)
Den maximala hastigheten för den enzymatiska reaktionen inträffar när substratkoncentrationen är mycket större än KM Och de katalytiska platserna för enzymerna är mättade med underlag. Detta inträffar när förhållandet [s]/[s] + kM Tillvägagångssätt till 1.
När [s] är lika med kM, Delen av ekvationen [s] / [s] + kM är lika med 1/2, vilket indikerar att kM Det är koncentrationen av substrat som producerar en enzymatisk reaktionshastighet som är hälften av den maximala hastigheten.
Dessutom KM Det är ett mått på affiniteten hos ett enzym av underlaget: desto större är värdet på KM, Mindre kommer att vara affiniteten hos enzymet för substratet och vice versa. Därför till en kM hög hastigheten på den enzymatiska reaktionen kommer att vara låg.
Lineweaver-Burk-graf
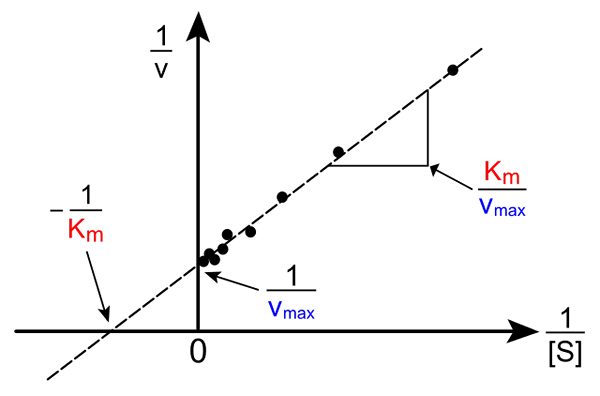 Lineweaver-Burk rak. Källa: Pro bug catcher via Wikipedia.
Lineweaver-Burk rak. Källa: Pro bug catcher via Wikipedia. Omvandlingen av Michaelis-Muene-ekvationen för att producera sin omvända form har följande form:
1/V = (kM / VMax) (1 / [s]) + 1 / vMax
Vikten av denna linje är att den har en korsning med X -axeln i - 1/kM, och med y -axeln vid y = 1/vMax (övre bild). Linjen har en lutning av kM/Vmax. Detta tillåter information om VMax och kM Grafera det omvända hastigheten beroende på det omvända underlagskoncentrationerna.
Referenser
- Strayer, L. (1975). Biokemi. 2ger Utgåva. Redaktör.
- Iran. Levin. (2009). Principer för fysikalik. Sjätte upplagan. MC Graw Hill.
- Wikipedia. (2020). Enzymkinetik. Hämtad från: i.Wikipedia.org
- Michael Blaber. (5 juni 2019). Enzymkinetik. Biologi librettexts. Återhämtad från: bio.Librettexts.org
- Redaktörerna för Enyclopaedia Britannica. (2020). Michaelis-Muen Kinetics. Återhämtat sig från: Britannica.com
- Berg JM, Tymoczko JL, Stryer L. Biokemi. Femte upplagan. New York: W H Freeman; (2002). Avsnitt.4: Michaelis-modellen står för de kinetiska egenskaperna hos många enzymer. Återhämtat sig från: NCBI.Nlm.Nih.Gov

