Klorhistoria, egenskaper, struktur, risker, användningar

- 4399
- 151
- PhD. Emil Svensson
han klor Det är ett kemiskt element som representeras av CL -symbolen. Det är den andra av halogenerna, belägen under fluoren, som också är det tredje mest elektronegativa elementet av alla. Hans namn härstammar från dess gulaktiga gröna färg, vilket är mer intensivt än fluor.
Populärt när någon lyssnar på sitt namn vad som först tycker är i blekprodukterna för kläderna och i poolens vatten. Även om klor fungerar effektivt i sådana exempel, är det inte dess gas, utan dess föreningar (särskilt hypoklorit) som utövar avfärgning och desinfektionsverkan.
 Rund kolv med gasformigt klor inuti. Källa: Larenmclane [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Rund kolv med gasformigt klor inuti. Källa: Larenmclane [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] I den övre bilden visas en rund kolv med gasformigt klor. Dess densitet är större än luften, vilket förklarar varför den förblir i kolven och inte flyr mot atmosfären; Som med andra lättare gaser, för att säga helium eller kväve. I detta tillstånd är det ett extremt giftigt ämne, eftersom det producerar saltsyra i lungorna.
Det är därför elementära eller gasformiga klor inte har för många användningsområden, mer än i någon syntes. Emellertid täcker dess föreningar, vare sig salter eller klorerade organiska molekyler, en bra repertoar av användningsområden, placerar bortom poolerna och kläderna från extrem vit.
Dessutom är dess atomer i form av kloridanjoner i våra kroppar och reglerar natrium-, kalcium- och kaliumnivåer samt i gastrisk juice. Om inte, skulle natriumkloridintaget vara ännu mer dödligt.
Klor förekommer genom saltlakeelektrolys, rik på natriumklorid, industriell process där natrium och vätehydroxid också erhålls. Och eftersom haven är en nästan outtömlig källa till detta salt är de potentiella reserverna för detta element i hydrosfären mycket stora.
[TOC]
Historia
Första tillvägagångssätt
På grund av den höga reaktiviteten hos den gasformiga kloren misstänkte antika civilisationer aldrig deras existens. Men deras föreningar var en del av mänsklighetens kultur från i går; Dess historia började kopplas till vanligt salt.
Å andra sidan uppstod klor från vulkanutbrott och när någon upplöst guld i kungligt vatten; Men ingen av de första tillvägagångssätten räckte för att formulera idén att denna gulaktiga gröna gas var ett sammansatt element.
Upptäckt
Upptäckten av klor tillskrivs den svenska kemisten Carl Wilhelm Scheele, som 1774 gjorde reaktionen mellan den pyrolusitiska mineral- och saltsyra (då kallad muriatinsyra).
Scheele stannar med krediten sedan han var den första forskaren som studerade klorens egenskaper; Även om han tidigare har erkänts (1630) av Jan Baptist Van Helmont.
Experimenten med vilka Scheele erhöll sina observationer är intressanta: Han utvärderade avfärgning av klor på rödaktiga och blåaktiga blommor av blommor, liksom i bladen på växter och insekter som dog direkt.
Han meddelade också sin höga reaktiva mot metaller, hans kvävande lukt och oönskad effekt på lungorna, och att när han upplöstes i vatten ökade hans surhet.
Oimuriasyra
Då ansåg kemikalier en syra för alla de föreningar som hade syre; Så de missade kloren borde vara en gasformig oxid. Det var så att de kallade det "oxyuriatic acid" (muriatinsyraoxid), namn myntat av den berömda franska kemisten Antoine Lavoisier.
Sedan 1809 försökte Joseph Louis Gay-Lussac och Louis Jacques Thénard att minska denna kolsyra; reaktion erhållen av metaller från deras oxider. På detta sätt ville de extrahera det kemiska elementet från den påstådda oximuratsyran (som de kallade 'deflistiska luft av muriatinsyra'.
Gay-Lussac och Thénard misslyckades emellertid i sina experiment; Men de lyckades när de överväger att nämnda gulaktig grön gas skulle vara ett kemiskt element och inte en förening.
Erkännande som ett element
Erkännandet av klor som ett kemiskt element var tack vare Sir Humphry Davy, som 1810 utförde sina egna experiment med kolelektroder och drog slutsatsen att det verkligen fanns en sådan oxid av muriatinsyra.
Och dessutom var det Davy som myntade namnet 'klor' för detta element från det grekiska ordet 'klor', vilket betyder gulaktigt.
När de studerade klorens kemiska egenskaper konstaterades att många av deras föreningar hade saltlösning; Därför utsåg de honom till en "halogen", vilket betyder försäljningsformator. Sedan användes termen halogen med de andra elementen i samma grupp (F, BR och I).
Michael Faraday lyckades till och med flytande2· H2ANTINGEN.
Kan tjäna dig: effektiv kärnbelastningResten av klorhistorien är kopplad till dess desinfektionsmedel och blekningsegenskaper, till utvecklingen av den industriella processen för saltlineelektrolys för att producera enorma mängder klor.
Fysiska och kemiska egenskaper
Fysiskt utseende
Det är en ogenomskinlig gulaktig grön tät gas, en irriterande tunnland lukt (en super intensifierad version av kommersiell klor) och är också extremt giftig.
Atomantal (z)
17
Atomvikt
35,45 u.
Om inget annat anges motsvarar resten av egenskaperna storlekar uppmätta för molekylklor, CL2.
Kokpunkt
-34,04 ºC
Smältpunkt
-101,5 ºC
Densitet
-Under normala förhållanden, 3,2 g/L
-Bara vid kokpunkten, 1,5624 g/ml
Observera att flytande klor är ungefär fem gånger mer än dess gas. Dessutom är densiteten för dess ånga 2,49 gånger större än luften. Det är därför kloren i den första bilden inte tenderar att fly från den runda kolven, eftersom den är tätare än luften är belägen i bakgrunden. Denna funktion gör fortfarande en farligare gas.
Fusionsvärme
6 406 kJ/mol
Förångningsvärme
20,41 kJ/mol
Molvärmekapacitet
33,95 J/(mol · k)
Vattenlöslighet
1,46 g/100 ml vid 0 ºC
Ångtryck
7,67 atm vid 25 ºC. Detta tryck är relativt lågt jämfört med andra gaser.
Elektronnegativitet
3.16 på Pauling -skalan.
Joniseringsenergier
-Först: 1251,2 kJ/mol
-Andra: 2298 kJ/mol
-Tredje: 3822 kJ/mol
Värmeledningsförmåga
8.9 · 10-3 W/(m · k)
Isotoper
Klor förekommer i naturen främst som två isotoper: 35Cl, med ett överflöd på 76%, och 37CL, med ett överflöd på 24%. Således är atomvikten (35,45 U) i genomsnitt atommassorna av dessa två isotoper, med sina respektive procentsatser av överflöd.
Alla klorradioisotoper är konstgjorda, bland vilka 36CL som den mest stabila, med ett halvt liv på 300 000 år.
Oxidationsnummer
Klor kan ha flera siffror eller oxidationstillstånd när det är en del av en förening. Som en av de mest elektronegativa atomerna i det periodiska tabellen har den vanligtvis negativa oxidationsnummer; Förutom när det går med syre eller fluor, i vars oxider respektive fluorider måste det "förlora" elektroner.
I dess oxidationsnummer antas existensen eller närvaron av joner med samma belastningsstorlek. Således har vi: -1 (cl-, Den berömda kloridanjonen), +1 (Cl+), +2 (Cl2+), +3 (Cl3+), +4 (Cl4+), +5 (Cl5+), +6 (Cl6+) och +7 (Cl7+). Av allt är -1, +1, +3, +5 och +7 de vanligaste i klorerade föreningar.
Till exempel, i CLF och CLF3 Oxidationsnumren för klor är +1 (Cl+F-) och +3 (Cl3+F3-). I cl2Eller detta är +1 (cl2+ANTINGEN2-); Medan i Clo2, Kli2ANTINGEN3 och cl2ANTINGEN7, Son +4 (cl4+ANTINGEN22-), +3 (Cl23+ANTINGEN32-) och +7 (Cl27+ANTINGEN72-).
I alla klorider, å andra sidan, har klor oxidationsnummer -1; som i fallet med NaCl (NA+Kli-), Där det är giltigt att säga att CL finns- Med tanke på denna salts joniska natur.
Elektronisk struktur och konfiguration
Klormolekyl
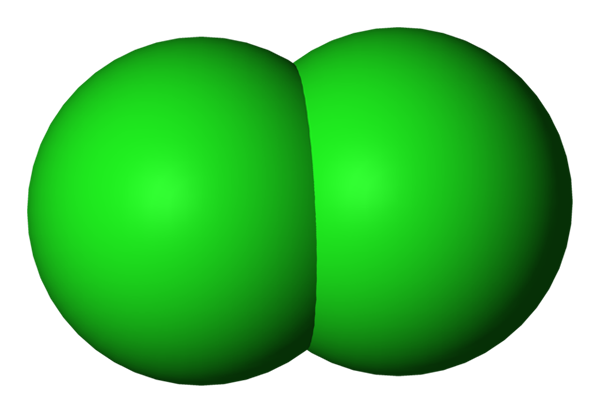 Diatomisk klormolekyl representerad med en rymdfyllningsmodell. Källa: Benjah-Bmm27 via Wikipedia.
Diatomisk klormolekyl representerad med en rymdfyllningsmodell. Källa: Benjah-Bmm27 via Wikipedia. Kloratomer i deras basaltillstånd har följande elektroniska konfiguration:
[NE] 3S2 3p5
Därför har var och en av sju elektroner i Valencia. Om de inte är överbelastade med energi kommer det att finnas enskilda atomer i rymden, som om de var gröna kulor. Men hans naturliga tendens är att bilda kovalenta bindningar mellan dem för att slutföra sina oktetter av Valencia.
Observera att de knappt behöver en elektron för att ha åtta valenselektroner, så de bildar en enda enkel länk; Detta är den som går med i två Cl -atomer för att skapa CL -molekylen2 (övre bild), Cl-Cl. Det är därför klor i normala och/eller markbundna förhållanden är en molekylgas; icke -monoatomiskt, som är fallet med ädla gaser.
Intermolekylär interaktioner
Molecula cl2 Det är homonukleärt och apolärt, så dess intermolekylära interaktioner styrs av spridningskrafterna i London och dess molekylmassor. I en sodafas, avståndet cl2-Kli2 Det är relativt kort jämfört med andra gaser som, tillsätt sin massa, gör den till en gas tre gånger mer än luften.
Ljus kan väcka och främja elektroniska övergångar inom molekylära orbitaler i CL2; Följaktligen visas dess karakteristiska gulaktiga gröna färg. Denna färg intensifieras i flytande tillstånd och försvinner sedan delvis när den stelnar.
Kan tjäna dig: svaga baserNär temperaturen går ner (-34 ºC), Cl-molekylerna2 De förlorar kinetisk energi och avståndet CL2-Kli2 minskar; Därför är de sammanhängande och slutar definiera flytande klor. Detsamma händer när systemet (-101 ºC) kyls ytterligare, nu med CL-molekylerna2 Så tillsammans definierar en ortorrombisk kristall.
Det faktum att det finns klordristaller indikerar att deras spridande krafter är tillräckligt riktade för att skapa ett strukturellt mönster; Detta är molekylära skikt av CL2. Separationen av dessa lager är sådan att även under ett tryck av 64 GPA är dess struktur modifierad, och de uppvisar inte heller elektriskt ledande.
Var är det och få
Kloridsalter
 Halitas robusta kristaller, bättre känd som vanligt eller bordsalt. Källa: Parent Géry [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Halitas robusta kristaller, bättre känd som vanligt eller bordsalt. Källa: Parent Géry [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Klor i dess gasformiga tillstånd kan inte hittas någonstans på jordens yta, eftersom det är mycket reaktivt och tenderar att bilda klorider. Dessa klorider är väl spridda över jordskorpan, och dessutom, efter miljoner år av att ha dragits av regnen, är haven och haven berikande.
Bland alla klorider är NaCl del mineralhalita (överlägsen bild) den vanligaste och rikliga; följt av Silvina, KCl och Carvalita, MGCL mineraler2· Kcl · 6h2ANTINGEN. När vattenmassorna avdunstas genom solens verkan lämnar öken salt sjöar, från vilka NaCl kan extraheras direkt som råmaterial för klor.
Saltlakeelektrolys
NaCl upplöses i vatten för att producera en saltlösning (26%), till vilken elektrolys utsätts för en kloralcalincell. Det finns två halvreaktioner i anoden och katodfacken:
2cl-(Ac) => cl2(g) + 2e- (Anod)
2h2Eller (l) + 2e- => 2OH-(Ac) + h2(g) (katod)
Och den globala ekvationen för båda reaktionerna är:
2NACL (AC) + 2H2Eller (l) => 2naOH (ac) + h2(g) + cl2(g)
När reaktionen äger rum, najoner+ Bildad vid anoden migrerar de till katodfacket som korsar ett permeabelt asbestmembran. Av den anledningen är NaOH på höger sida av den globala ekvationen. Båda gaserna, cl2 och h2, De samlas in från anoden respektive katod.
Den lägre bilden illustrerar den nya skriftliga:
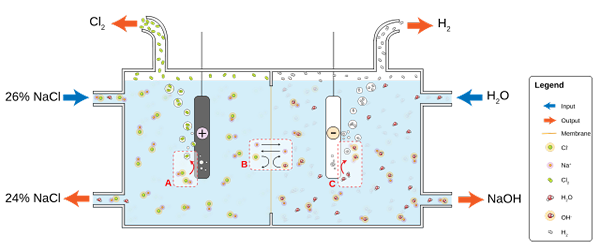 Diagram för klorproduktion genom saltlakeelektrolys. Källa: JKwchui [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Diagram för klorproduktion genom saltlakeelektrolys. Källa: JKwchui [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Observera att koncentrationen av saltlösningen i slutet minskar med 2% (den går från 24 till 26%), vilket innebär att en del av dess CL- Original omvandlas till CL -molekyler2. I slutändan har industrialiseringen av denna process beviljat en metod för att producera klor-, väte- och natriumhydroxid.
Sur upplösning av pyrolusit
Som nämnts i historien kan det gasformiga klor produceras genom att lösa prover av pyrolusitmalm med saltsyra. Följande kemisk ekvation visar de produkter som erhållits från reaktionen:
Mne2(S) + 4HCl (AC) => MCL2(AC) + 2H2Eller (l) + cl2(g)
Legeringar
Det finns inga klorlegeringar av två enkla skäl: deras gasformiga molekyler kan inte fångas bland metallkristaller, och dessa är också mycket reaktiva, så de skulle reagera omedelbart med metaller för att producera sin respektive klorid.
Å andra sidan är klorider inte heller önskvärda, eftersom när de har upplösts i vatten utövar de en saltlösningseffekt som främjar korrosion i legeringar; Och därför upplöses metaller för att bilda metallklorider. Korrosionsprocessen för varje legering är annorlunda; Vissa är mer mottagliga än andra.
Klor är följaktligen inte ett bra tillsats för legeringar alls; inte heller som CL2 inte heller som CL- (Och atomerna skulle vara mycket reaktiva så att de till och med kan existera).
Risker
Även om lösligheten av klor i vatten är låg, räcker det att producera i fuktigheten i vår hud och ögon saltsyran, som slutar korrodera vävnaderna som orsakar allvarliga irritationer och till och med förlust av syn.
Ännu värre är att andas sina gulaktiga grönaktiga ångor, eftersom det en gång i lungorna igen genererar syror och skadar lungvävnaden. Med detta upplever personen halssmärta, hosta och andningssvårigheter på grund av vätskor som bildas i lungorna.
Om det finns en klorflykt står det inför en särskilt farlig situation: luft kan inte bara "svepa" sina ångor; stanna där tills de reagerar eller sprids långsamt.
Kan tjäna dig: Precision Balance: Egenskaper, funktioner, delar, användningarUtöver detta är det en mycket oxiderande förening, så flera ämnen kan reagera explosivt med honom till minsta kontakt; Som med stålull och aluminium. Det är därför där det finns en lagrad klor, alla nödvändiga överväganden måste vidtas för att undvika brandrisker.
Ironiskt nog, medan gasformigt klor är dödligt, är dess kloridjon inte giftig; Det kan konsumeras (med mått), brinner inte eller reagerar utom med fluor och andra reagens.
Ansökningar
Syntes
Cirka 81 % av den gasformiga klor som produceras årligen är avsett för syntes av organiska och oorganiska klorider. Beroende på graden av kovalens av dessa föreningar kan klor hittas som enbart klatomer i klorerade organiska molekyler (med C-Cl-bindningar), eller som Cl-joner- I några kloridsalter (NaCl, CaCl2, Mgcl2, etc.).
Var och en av dessa föreningar har sina egna tillämpningar. Till exempel kloroform (CHCL3) och etylklorid (CH3Ch2Cl) är lösningsmedel som har kommit att användas som inandningsbedövningsmedel; Diklorometano (ch2Kli2) och koltetraklorid (CCL4), För sin del används de i allmänhet i organiska kemilaboratorier.
När dessa klorerade föreningar är flytande är de för det mesta avsedda som lösningsmedel för organiska reaktioner betyder.
I andra föreningar representerar närvaron av kloratomer en ökning vid dipolmomentet, så att de kan interagera i högre grad med en polär matris; en bildad av proteiner, aminosyror, nukleinsyror, etc., biomolekyler. Således har klor också papper i syntesen av läkemedel, bekämpningsmedel, insekticider, fungicider etc.
Beträffande oorganiska klorider används de vanligtvis som katalysatorer, råmaterial för att erhålla metaller genom elektrolys eller källor källor-.
Biologisk
Gasformiga eller elementära klor har ingen roll inom levande varelser mer än att förstöra deras vävnader. Detta betyder dock inte att deras atomer inte kan hittas i kroppen. Till exempel Cl -joner- De är mycket rikliga i det cellulära och extracellulära mediet och hjälper till att kontrollera najonnivåerna+ och ca2+, för det mesta.
På samma sätt är saltsyra en del av magsaften med vilken maten smälts i magen; dess Cl -joner-, I sällskap med h3ANTINGEN+, Definiera pH nära 1 av dessa sekretioner.
Kemiska vapen
Densiteten för den gasformiga kloren gör det till ett dödligt ämne när den spillas eller hälls i stängda eller öppna utrymmen. Att vara tätare än luft, en ström av den drar inte lätt klor, så det kvarstår under en betydande tid innan det äntligen sprids.
Under första världskriget användes till exempel detta klor på slagfält. När han släpptes, smög han in i skyttegraven för att kväva soldaterna och tvinga dem att gå till ytan.
Desinfektionsmedel
 Poolerna är kloroniserade för att undvika reproduktion och spridning av mikroorganismer. Källa: Pixabay.
Poolerna är kloroniserade för att undvika reproduktion och spridning av mikroorganismer. Källa: Pixabay. De kloroniserade lösningarna, de där gasformiga klor har upplösts i vatten och sedan alkaliseras med en buffert, har utmärkta desinfektionella egenskaper, samt hämma vävnadens råtta. De har använts för att desinficera öppna sår för att eliminera patogena bakterier.
Poolvatten är exakt kloroniserat för att eliminera bakterier, mikrober och parasiter som kan hysa det. För detta ändamål brukade gasformigt klor användas, men dess verkan är ganska aggressiv. Istället används natriumhypokloritlösningar (blekmedel) eller trikloroisokianursyra (ATC) (ATC) (ATC).
Föregående visar att det inte är CL2 Den som utövar den desinfektionella verkan men HCLO, hypoklorityra, som producerar radikaler eller · som förstör mikroorganismer.
Bleka
Mycket liknar dess desinfektionella verkan, klor blekar också materialen eftersom färgerna som är ansvariga för HCLO. Således är dess kloroniserade lösningar idealiska för att ta bort fläckarna från vita plagg eller för att bleka pappersmassa.
Polyvinylklorid
Den viktigaste klorerade föreningen av alla, för vilken cirka 19% av den återstående produktionen av gasformigt klor tilldelas, är vinylpolyklorid (PVC). Denna plast har flera användningsområden. Med det tillverkas vattenrör, fönsterramar, väggar i väggar och golv, elektriska ledningar, intravenösa väskor, rockar, etc.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2019). Klor. Hämtad från: i.Wikipedia.org
- Laura H. et al. (2018). Struktur av fast klor vid 1.45 gpazeitschrift für Kristallgraphie. Kristallina material, volym 234, nummer 4, sidor 277-280, ISSN (online) 2196-7105, ISSN (tryck) 2194-4946, doi: doi.org/10.1515/ZKRI-2018-2145
- Nationellt centrum för bioteknikinformation. (2019). Klor. Pubchemdatabas. CID = 24526. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Marques Miguel. (s.F.). Klor. Återhämtat sig från: nautilus.Fis.Uc.Pt
- American Chemistry Council. (2019). Klorkemi: Introduktion till klor. Återhämtat sig från: klor.Amerikan.com
- Fong-yan ma. (s.F.). Frätande effekter av klorider på metaller. Department of Marine Engineering, Ntou Republic of China (Taiwan).
- Delstaten New York. (2019). Fakta om klor. Återhämtat sig från: hälsa.Ny.Gov
- Doktor. Doug Stewart. (2019). Klorelement fakta. Kemikkolis. Återhämtat sig från: Chemicool.com

