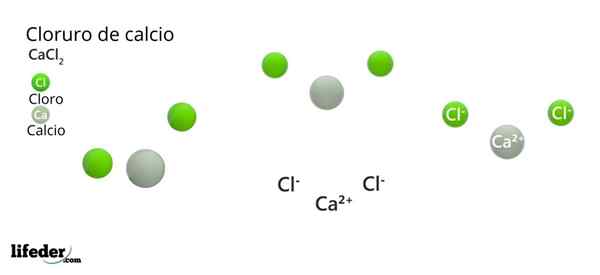
Kalciumklorid (CaCl2)
- 4993
- 1066
- Anders Svensson
Vi förklarar vilken kalciumklorid, dess struktur, fysiska och kemiska egenskaper, hur den syntetiseras och dess tillämpningar är
Vad är kalciumklorid?
han kalciumklorid (CaCl2) Det är ett oorganiskt salt som består av kalcium, alkalisk metall och halogenklor. I den föreningen finns det flera elektrostatiska interaktioner som definierar det yttre utseendet på deras kristaller och resten av dess fysiska egenskaper.
Det åtföljs också av vattenmolekyler och bildar COCL General Formula Hydrates2· Xh2Eller, med x = 0, 1, 2, 4 och 6. När x = 0 saknar saltet vatten och är anhydrid, vilket indikeras av dess kemiska formel som nämns ovan.
I den överlägsna bilden illustreras några fasta delar av CaCl2. I förhållanden med liten luftfuktighet är det möjligt.
Formel
Dess kemiska formel är CaCl2: Uttrycker att för varje cajon2+ Det finns två Cl -joner- som neutraliserar den positiva belastningen. Kalciummetallen av grupp 2 i den periodiska tabellen (SR. Scholambara)- ger sina två elektroner till varje kloratom, gruppelement 17.
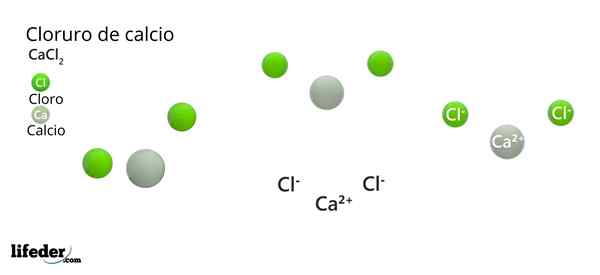
Kalciumkloridstruktur
I den överlägsna bilden illustreras CaCl -strukturen2 anhydrid. Gröna sfärer motsvarar Cl -joner-, Medan vita till jonerna CA2+. Dessa sfärer är fixerade i en parallellepiped, vilket är inget annat än den enhetliga ortorrombiska cellen i kristallerna.
Strukturen kan ge den falska idén att kalcium dominerar; Men om fler repetitioner av enhetscellen reproduceras, skulle det största överflödet av de gröna sfärerna vara tydliga: Cl -jonerna-.
Å andra sidan, CA -joner2+ De har mindre joniska radioapparater än Cl -joner-. Detta beror på att när de förlorar elektroner utövar atomerna i större attraktiv kraft på de yttre elektroniska skikten, vilket minskar den joniska radien.
När det gäller CL-, Detta har en extra elektron som inte kan lockas till samma kraft, vilket ökar dess jonradie.
Kan tjäna dig: vattenhaltiga lösningarMolekylgeometri och vattenhaltiga kalciumkomplex
I mitten av parallellenpipen CA2+ Det är omgivet av sex cl-. Fyra av dessa ligger i ett fyrkantigt plan och de andra två ligger vinkelrätt (de mest avlägsna gröna sfärerna i den vita sfären).
Som ett resultat av arrangemanget av dessa joner, runt CA2+ En octaedro är "vapen" och tilldelar således en oktaedral molekylgeometri.
Med tanke på hur gröna sfärer är ordnade kan en vattenmolekyl ersätta en av dessa, vilket inträffar med stroke2· H2Eller, eventuellt i det fyrkantiga planet. Detta faktum modifierar den kristallina strukturen och när vattnet ersätter de gröna sfärerna förändras jonarrangemanget mer.
När alla Cl -joner- De ersätts av vattenmolekyler, CaCl -hydrat bildas2· 6h2ANTINGEN. Vid denna tidpunkt är octahedronen "vattenhaltig" och molekylerna kan nu interagera mellan dem med vätebroar (CA2+ Oh-h-oh2).
I följd kan kalcium acceptera ännu mer vattenmolekyler utan att förändra den etablerade andelen. Detta betyder att CaCl2· 6h2Eller kan anta andra komplexa strukturer, så att man överväger kristallina polymerer av kalcium och vatten.
Dessa strukturer är emellertid mindre stabila än de som uppförs av elektrostatiska interaktioner (CA2+ och cl-) från anhydridsalt.
Användning/tillämpningar av kalciumklorid
De viktigaste tillämpningarna av kalciumklorid är:
- Undvik att frysa vatten under vintern. Kalciumklorid genererar mycket värme vid upplösning och sedan ökar temperaturen, isfusion inträffar. Av denna anledning används det för att minska risken för cirkulation av människor och fordon under kallstationen.
- Hjälpa till att kontrollera damm på olagda vägar.
- Påskynda betongens torkningshastighet när.
- Cachlvätskor2 Borrningens effektivitet för gasuttag från deras underjordiska avlagringar ökar samt olja.
- Pooler läggs till för att minska erosionen som drabbats av dess väggar. Sedimenterad kalcium uppfyller denna funktion.
- Eftersom det är ett hygroskopiskt salt kan kalciumklorid användas som ett dissektiv, att kunna sänka fukten i den omgivande luften och därför från ämnen i kontakt med den luften.
- Det används som konserveringsmedel i vissa livsmedel, liksom tillsatser i flera, till exempel energidrycker som används av idrottare, ostar, öl, etc.
- I medicinsk praxis har det också användbarhet vid behandling av depression orsakad av en överdos av magnesiumsulfat, liksom vid blyförgiftning.
Syntes av kalciumklorid
De naturliga källorna till denna förening är Salmueras som extraheras från haven eller sjöarna.
Emellertid kommer dess huvudkälla från Solvay -processen, där kalkstenen (Caco3) drabbas av en serie transformationer tills de härleds i by -produktens kalciumklorid:
2NACL (AQ) + Caco3(S) Na2Co3(S) + CaCl2(Ac)
Produkten av intresse för denna process är faktiskt natriumkarbonat, NA2Co3.
Egenskaper hos kalciumklorid
Fysikaliska egenskaper och delicuescens
Det är en vit, toalett och hygroskopisk fast ämne. Denna tendens att absorbera fukt i miljön beror på basens basicitet2+.
Basicitet av vilken typ: av Lewis eller Bronsted? Lewis, eftersom den positiva arten kan acceptera elektroner. Dessa elektroner doneras till exempel av syreatomer av vattenmolekyler.
Den fasta absorberar fukt till graden av upplösning i samma vatten som väter dess kristaller. Den här egenskapen är känd som delicuescencia.
Dess densitet är 2,15 g/ml. När den integrerar vatten i sin struktur är kristallen "utvidgad", ökar dess volym och följaktligen minskar densiteten. Endast CaCl2· H2O bryt med denna trend och visar en större densitet (2,24 g/ml).
Molekylvikten av anhydridsalt är ungefär 111 g/mol, och för varje vattenmolekyl i dess struktur ökar denna vikt 18 enheter.
Löslighet
CaCl2 Det är mycket lösligt i vatten och i vissa polära lösningsmedel, såsom etanol, ättiksyra, metanol och andra alkoholer.
Värmevärme
När processen upplöses i vatten är den exoterm och upphettade därför lösningen och dess omgivningar.
Kan tjäna dig: var kommer plast ifrån? Historia och typerDetta beror på att det vattenhaltiga komplexet bättre stabiliserar cajonerna2+ I lösning att elektrostatiska interaktioner med Cl -joner-. Eftersom produkten är mer stabil frigör de fasta energin i form av värme.
Elektrolytisk sönderdelning
CaCl2 Molten kan underkastas elektrolys, fysisk process som består i separationen av en förening i dess element från verkan av en elektrisk ström. När det gäller detta salt är produkterna metalliskt kalcium och gasformigt klor:
CaCl2(L) → CA (S) + CL2(g)
Jonerna Ca2+ De reduceras i katoden, medan Cl -joner- De oxideras vid anoden.
Referenser
- Wikipedia. (2018). Kalciumklorid. Hämtas från.Wikipedia.org
- Shiver & Atkins. (2008). Oorganisk kemi. I grupp 2 -element. (Fjärde upplagan., p. 278). MC Graw Hill.
- Pub. (2018). Kalciumklorid. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Oxik. Kalciumklorid: En guide till fysiska egenskaper. Oxy återhämtade sig.com
- Carole Ann. Vanlig användning av kalciumklorid. Hunker återhämtade sig.com