Koldisulfid (CS2) struktur, egenskaper, användningar, risker
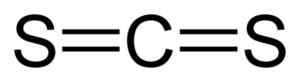
- 2806
- 872
- Johan Olsson
han koldisulfid Det är en förening som bildas av föreningen av en kolatom (C) och två svavelatomer (er). Dess kemiska formel är CS2. Det är en färglös eller något gul vätska med en obehaglig lukt på grund av de föroreningar som den innehåller (svavelföreningar). När ren lukten är mjuk och söt, liknande kloroform eller eter.
Det härstammar naturligtvis från solljusets verkan på organiska molekyler som finns i havsvatten. Dessutom förekommer det i träskvatten och förvisas också från vulkaner tillsammans med andra gaser.
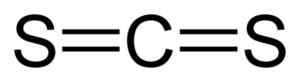 CS koldisulfid2. Författare: Benjah-Bmm27. Källa: Wikimedia Commons.
CS koldisulfid2. Författare: Benjah-Bmm27. Källa: Wikimedia Commons. Kolisulfid är en flyktig vätska och är också mycket brandfarlig, så den måste hållas borta från lågor och gnistor eller enheter som kan producera dem, inklusive elektriska glödlampor.
Det har förmågan att lösa upp ett stort antal föreningar, material och element, såsom fosfor, svavel, selen, hartser, lack, etc. Därför finner det verktyg som ett lösningsmedel.
Det är också mellanhand i olika industriella kemiska reaktioner, såsom rayonproduktion eller konstgjord siden.
Det måste manipuleras med försiktighet och med skyddsredskap eftersom det är mycket giftigt och farligt.
[TOC]
Strukturera
Koldisulfid har en kolatom och två svavelatomer på sidorna av detta.
Länkarna mellan kolatomen och svavelatomerna är kovalenta och dubbla, därför är de mycket starka. CS -molekylen2 Den har en linjär och symmetrisk struktur.
 Linjär struktur av koldisulfid CS2. Svart = kol, gul = svavel. Författare: Benjah-Bmm27. Källa: Wikimedia Commons.
Linjär struktur av koldisulfid CS2. Svart = kol, gul = svavel. Författare: Benjah-Bmm27. Källa: Wikimedia Commons. Nomenklatur
- Koldisulfid
- Kolbisulfid
- Gitering
Egenskaper
Fysiskt tillstånd
Färglös till gulaktig.
Molekylvikt
76,15 g/mol
Fusion eller stelningspunkt
-110,8 ° C
Kokpunkt
46,0 ºC
Flampunkt
-30 ºC (stängd koppmetod).
Självriktningstemperatur
90 ° C
Densitet
Vätska = 1,26 g/cm3 vid 20 ºC.
Ånga = 2,67 gånger luften.
Dess ångor är mer än dubbel tunga än luft och vätska är tyngre än vatten.
Ångtryck
279 mmHg vid 25 ° C.
Kan tjäna dig: kaliumhypoklorit (KCLO)Detta är ett högt ångtryck.
Löslighet
Mycket lite vattenlösligt: 2,16 g/L A 25 ° C. Löslig i kloroform. Belopp med etanol, metanol, eter, bensen, kloroform och koltetraklorid.
Kemiska egenskaper
CS2 Det avdunstar lätt vid rumstemperatur eftersom dess kokpunkt är mycket låg och ångtrycket är mycket högt.
Kolisulfid är extremt brandfarligt. Hans ångor är mycket lätt inflammerade, även med värmen från en elektrisk glödlampa. Detta innebär att det reagerar med syre mycket snabbt:
Cs2 + 3 o2 → CO2 + 2 så2
Det faktum att du har högt ångtryck vid rumstemperatur gör det farligt att vara nära en låga.
När de värms upp till sönderdelning kan lätt utnyttja, avger giftiga gaser från svaveloxider. Över 90 ° C slås den spontant.
Det bryts ned när det lagras länge. Attackera koppar och dess legeringar. Det reagerar också med vissa plast, gummi och beläggningar.
Reagerar under vissa förhållanden med vatten och bildar OCS karbonylsulfid, koldioxid Co2 och väte disulfid h2S:
Cs2 + H2O → OCS + H2S
Cs2 + 2 h2O → CO2 + 2 h2S
Med alkoholer (ROH) i det alkaliska mediet bildar xantater (RO-CS-NNA):
Cs2 + ROH + NAOH → H2Eller + ro -c (= s) -sna
Erhållande
Kolisulfid framställs kommersiellt genom svavelreaktion med kol. Processen utförs vid temperaturer på 750-900 ° C.
C + 2 S → CS2
Istället för kol kan du också använda metan eller naturgas, och till och med etan, propan och propylen har använts, i vilket fall reaktionen inträffar vid 400-700 ° C med hög prestanda.
Det kan också framställas genom att reagera naturgas med vätesulfid h2S en mycket hög temperatur.
Närvaro
CS2 Det är en naturlig produkt som finns i atmosfären i mycket små mängder (spår). Det förekommer fotokemiskt i ytvatten.
Handlingen av solljus på vissa föreningar som finns i havsvatten såsom cystein (en aminosyra) leder till koldisulfidbildning.
 Koldisulfid kan bildas genom verkan av solstrålar på vissa organiska föreningar som finns i havsvatten. Författare: Pexels. Källa: Pixabay.
Koldisulfid kan bildas genom verkan av solstrålar på vissa organiska föreningar som finns i havsvatten. Författare: Pexels. Källa: Pixabay. Det släpps också naturligt under vulkanutbrott och finns i små mängder över träsk.
Kan tjäna dig: bensaldehydNormalt utsätts vi för att andas in mycket små proportioner och finns i vissa livsmedel. Det finns också i cigaretternas rök.
I miljön sönderdelas den genom solljus. På marken rör sig den genom den. Vissa markmikroorganismer bryts ned.
Ansökningar
I den kemiska industrin
Kolisulfid är en viktig kemisk förening eftersom den tjänar till att förbereda andra kemikalier. Kan fungera som en kemisk mellanhand.
Det används också som ett processlösningsmedel till exempel för att lösa fosfor, svavel, selen, brom, jod, fetter, hartser, vax, lack och gummi.
Tillåter bland annat tillverkning av läkemedelsprodukter och herbicider.
I produktionen av Rayón och Celofán
Med CS2 Xantatos är beredda som är föreningar som används vid tillverkningen av Rayón och Celofán.
För att få konstgjord siden eller rayon är den baserad på cellulosa som behandlas med alkali och koldisulfid CS2 och förvandlas till cellulosa xantat, lösligt i alkali. Denna lösning är viskös och kallas därför "Viscosa".
Viskosen görs under tryck genom mycket små hål inuti ett syrabad. Här förvandlas cellulosa xantatet igen till cellulosa som är olöslig och långa och ljusa trådar bildas.
Trådar eller filament kan spinnas för att ge ett material som kallas Rayón.
(1) Cellulosa + NaOH → Alkali-Celulosa
ROH + NAOH → RONA
(2) Alkali-celulosa + koldisulfid → cellulosa xantat
Rona + s = c = s → ro -c (= s) -sna
(3) xantat av cellulosa + syra → cellulosa (filament)
RO -C (= S) -SNA + ACID → ROH
 Kläder gjorda med rayon, fiber vars tillverkning deltar koldisulfid. Tobias "ta" Maier [CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons.
Kläder gjorda med rayon, fiber vars tillverkning deltar koldisulfid. Tobias "ta" Maier [CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons. Om cellulosan fälls ut genom att passera xantato genom en smal plats, regenuleras cellulosen i form av tunna ark som utgör cellofanen. Detta är mjukat med glycerol och används som en objektskyddsfilm.
 Cellofanen tillverkas med hjälp av koldisulfid. Författare: Hans Braxmeier. Källa: Pixabay.
Cellofanen tillverkas med hjälp av koldisulfid. Författare: Hans Braxmeier. Källa: Pixabay. Vid produktion av koltetraklorid
Kolisulfid reagerar med klor CL2 För att ge koltetraklorid CCL4, vilket är ett viktigt lösningsmedel som inte är bränsle.
Kan tjäna dig: klorbensen (C6H5Cl)Cs2 + 3 Cl2 → CCL4 + S2Kli2
I flera applikationer
Kolisulfid deltar i den kalla vulkaniseringen av gummi.
Xantatos tillagade med CS2 De används i mineralflotation.
Gamla användningsområden
CS2 Det är ett gift för levande organismer. Tidigare användes det för att förstöra skadedjur som råttor, marmoter och myror, och hällde vätskan i varje stängt utrymme där dessa djur bodde (hålor och hormigueros))).
När de täta giftiga ångorna användes för detta ändamål slutade de varje levande organisme som var i det trånga utrymmet.
Det användes också som antihelmintik för djur och för att eliminera larver från moscardons från hästens mage.
I jordbruket användes det som insektsmedel och nematicide för att fumigera jorden, till rökning av plantskolor, lador, silor och spannmålskvarnar. Järnvägsbilar, fartyg och pråmar fumigerades också.
 Bonde 1904 som röker jorden med koldisulfid för att bekämpa en pest av druvanläggningar. Ölgemälde von Hans Pühringer, 1904 [GFDL 1.2 (http: // www.gnu.Org/licenser/gamla licenser/FDL-1.2.html)]. Källa: Wikimedia Commons.
Bonde 1904 som röker jorden med koldisulfid för att bekämpa en pest av druvanläggningar. Ölgemälde von Hans Pühringer, 1904 [GFDL 1.2 (http: // www.gnu.Org/licenser/gamla licenser/FDL-1.2.html)]. Källa: Wikimedia Commons. Alla dessa användningsområden var förbjudna på grund av CS: s höga brandfarlighet och toxicitet2.
Risker
CS2 Det är mycket brandfarligt. Många av dina reaktioner kan orsaka eld eller explosion. Blandningarna av deras ångor med luft är explosiva. När inflammering producerar irriterande eller giftiga gaser.
Koldisulfiden för avloppet ska inte hällas, för i rören finns en blandning av CS2 och luft som kan orsaka en explosion om den tänds av misstag.
Hans ångor skjuter spontant i kontakt med gnistor eller heta ytor.
Koldisulfid irriterar allvarligt ögon, hud och slemhinnor.
Om det centrala nervsystemet inhaleras eller intas på allvar, det kardiovaskulära systemet, ögonen, njurarna och levern. Det kan också absorberas genom huden orsakar skador.
Referenser
- ELLER.S. National Library of Medicine. (2020). Disulfidkol. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Mopper, k. Och Kieber, D.J. (2002). Fotokemi och cykling av kol, svavel, kväve och pospherus. I biogeokemitet av marin upplöst organiskt material. Återhämtat sig från Scientedirect.com.
- Meyer, b. (1977). Industriell användning av svavel och dess kompund. Disulfidkol. I svavel, energi och avund. Återhämtat sig från Scientedirect.com.
- Pohanish, r.P. (2012). C. Disulfidkol. I Sittigs handbok av giftiga och farliga kemikalier och cancerframkallande ämnen (sjätte upplagan). Återhämtat sig från Scientedirect.com.
- Morrison, r.T. och Boyd, r.N. (2002). Organisk kemi. Sjätte upplagan. Prentice-hall.
- Windholz, m. et al. (redaktörer) (1983). Merck -indexet. En enyklopedi av kemikalier, droger och biologiska. Tionde upplagan. Merck & Co., Inkl.

