Aktiverings energi
- 2308
- 580
- Johan Olsson
Vi förklarar vad som är aktiveringsenergin, dess formel, enheter, hur den beräknas och vi ger flera exempel
Vad är aktiveringsenergi?
De aktiverings energi (OCHtill) Det definieras som den minsta energi som krävs för att en kemisk reaktion ska genomföras. Med andra ord är det energibarriären som måste övervinnas så att reagens kan bli produkter.
Aktiveringsenergi kan ses i handling i det dagliga livet. Vi vet faktiskt att när den öppnar gaspassagen i köket brinner den inte omedelbart när den kommer i kontakt med luften.
Så att förbränningsreaktionen börjar är det nödvändigt att tillhandahålla en gnista eller eld på en match på. Denna gnista eller denna eld representerar aktiveringsenergin för förbränningsreaktionen.
Varför krävs en aktiveringsenergi?
För att förstå orsaken till att reaktioner behöver en lägsta energi för att inträffa är det i första hand viktigt att förstå hur de inträffar. För två atomer eller molekyler att reagera måste de först kollidera. Dessutom måste de göra det med rätt orientering så att nya kemiska bindningar kan bildas och de gamla människorna kan bryta.
Men även om de två molekylerna riktas till varandra med den perfekta orienteringen, säkerställer detta inte att en effektiv kollision ges på grund av avvisningen mellan molekylernas elektroner.
Av denna anledning är det nödvändigt att molekylerna, utöver en korrekt orientering, också reser med viss hastighet eller med lite minimal kinetisk energi som säkerställer att kollisionen är tillräckligt stark för att motverka avstötningen av elektroner.
Denna minsta kinetiska energi som krävs på mikroskopisk nivå är den som översätter till reaktionsaktiveringsenergin.
Kan tjäna dig: litiumbromid: struktur, egenskaper, användningar, riskerVad som ses i ett energidiagram?
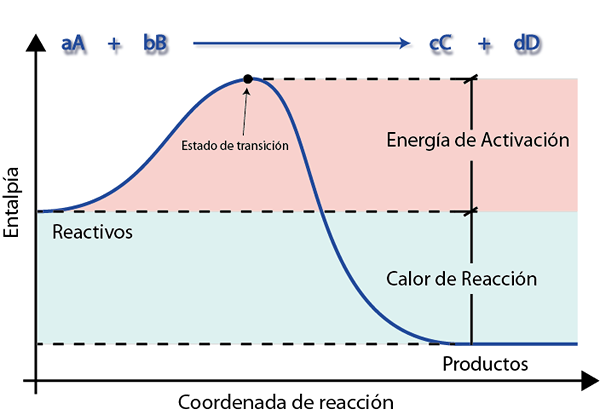
Ett energidiagram är en grafisk representation som visar hur reagensens energi varierar när de förvandlas till produkter. I dessa diagram, till exempel den som presenteras nedan, är det lätt att se och tolka aktiveringsenergi.

I denna graf visar den blå linjen energin när reaktionen fortskrider. Här kan du se att reagensen för att bli produkterna måste först övervinna en kulle för att nå övergångstillståndet. Annars kommer de att återlämnas till sitt ursprungliga tillstånd.
Höjden på denna kulle är exakt aktiveringsenergi. Om det är möjligt att övervinna är resten av vägen nedförsbacke och reagensen slutar snabbt och blir snabbt produkterna.
Aktiveringsenergi enheter
Aktiveringsenergi är en intensiv storlek som uttrycks i energienheter över massa eller mol. Eftersom det finns olika energienheter och olika massenheter kan aktiveringsenergi uttryckas i flera olika enheter. Men de som används oftast i kemi är:
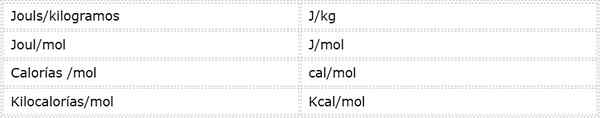
Vilken enhet som används beror på de data från vilka den beräknas, eller användningen som kommer att anges i andra beräkningar.
Aktiveringsenergiformel
Aktiveringsenergi är relaterad till reaktionshastighet. Faktum är att ju större aktiveringsenergi, desto lägre hastighet. Detta förhållande uttrycks matematiskt genom Arrhenius -ekvationen, som relaterar hastighetskonstanten för en reaktion på temperaturen.
Kan tjäna dig: Benedict Reagent: Vad är det för, komponenter, förberedelser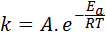
I denna ekvation, k Det är hastighetskonstanten för reaktionen ochtill Det är aktiveringsenergin, r är konstanten för de ideala gaserna, t är den absoluta temperaturen och kallas Arrhenius före exponentiell faktor, även kallad en kollisionsfaktor.
Denna ekvation kan omarrangeras för att ge:
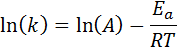
Om värdet på A för reaktionen är känd kan aktiveringsenergin erhållas genom att rensa den tidigare ekvationen. Detta är emellertid inte det sätt på vilket aktiveringsenergin för en reaktion vanligtvis bestäms. Normalt bestäms hastighetskonstanten vid två eller flera temperaturer, vilket gör det onödigt att veta.
Hur beräknas aktiveringsenergi?
Aktiveringsenergi bestäms utifrån hastighetskonstantens värden vid olika temperaturer. Minst två värden på k mätt vid olika t -värden för att beräkna aktiveringsenergi utan att veta, vilket vanligtvis är fallet.
Beroende på hur många värden på k De har, du kan beräkna ochtill På två sätt:
1. När du har k vid två temperaturer
I dessa fall är det lättare att starta från den första formen av Arrhenius -ekvationen. Om vi ringer k1 till hastighetskonstanten vid temperaturen T1 och k2 till hastighetskonstanten vid temperaturen T2, Då kan vi skriva Arrhenius -ekvationen två gånger:
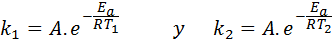
Nu kan vi dela alla av de två ekvationerna mellan den andra för att avbryta A:
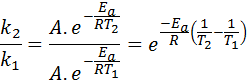
Sedan tar Neperian logaritm på båda sidor och löser för Etill, erhålles:
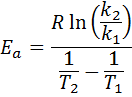
2. När du har k Mer än två temperaturer
I fall där det finns flera bestämningar av hastighetskonstanten vid olika temperaturer är det att föredra att hitta aktiveringsenergin grafiskt eller med hjälp av linjär regression. Detta är baserat på ekvationen i logaritmisk form, som har formen på en linje:
Det kan tjäna dig: Clausius-Clapeyron-ekvation: Vad är det för, exempel, övningar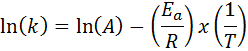
Om vi gör en graf över ln (k) kontra (1/t) kommer vi att få en rak linje som skär till axeln och i ln (a) och vars lutning är lika med -(etill/R). Därifrån erhålls aktiveringsenergin.
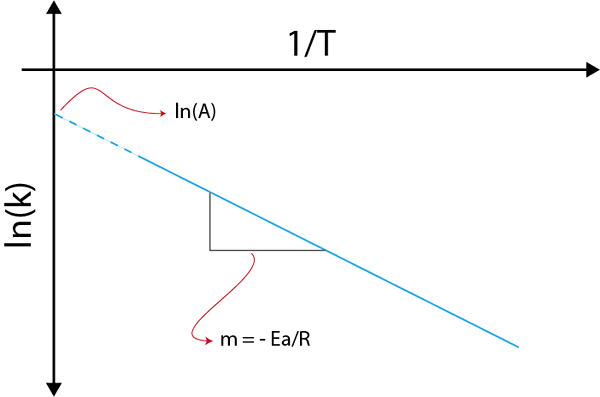 Arrhenius graf för att bestämma aktiveringsenergi
Arrhenius graf för att bestämma aktiveringsenergi Exempel på beräkning av aktiveringsenergier
Exempel 1
Hastighetskonstanten för en första ordningsreaktion bestämdes vid två olika temperaturer. 298 K hade ett värde på 0.058 s-1, Medan 350 K ökade värdet till 0,425 s-1. Bestäm aktiveringsenergin för denna reaktion i J/mol.
- Lösning: Eftersom du har konstanten vid två temperaturer kan aktiveringsenergiformeln som visas ovan användas direkt. Eftersom energin begärs i J/molenheter, måste vi använda gaskonstanten i dessa enheter:
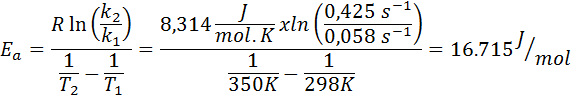
Exempel 2
Hastighetskonstant för en andra ordning kemisk reaktion mäts vid olika temperaturer. Värdena presenteras i följande tabell. Bestäm aktiveringsenergin i kcal/mol.
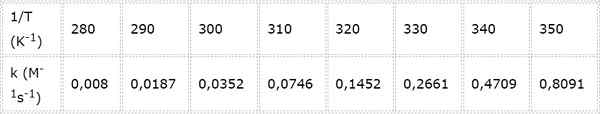
- Lösning: Liksom i detta fall finns det flera temperaturer, det är att föredra att bestämma aktiveringsenergin grafiskt. För att göra detta görs en graf av ln (k) vs 1/t, som presenteras nedan.
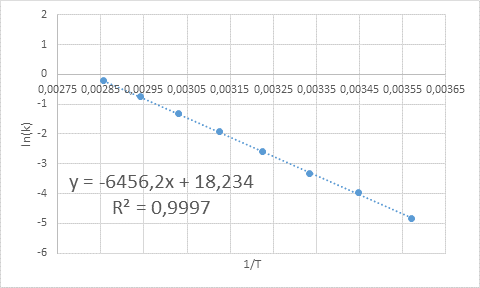 Exempel på grafisk bestämning av aktiveringsenergi
Exempel på grafisk bestämning av aktiveringsenergi Från ekvationen av linjen som visas i grafen erhålls lutningen, som är -6456.2. Eftersom lutningen (m) är lika med - etill/R, då:
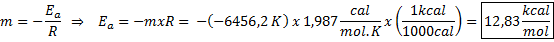
Det vill säga aktiveringsenergin för denna reaktion är 12,83 kcal/mol.

