Icke -polär kovalent bindning
- 4593
- 46
- Johan Eriksson
Vi förklarar vad en icke -polär kovalent bindning är, dess egenskaper och flera exempel
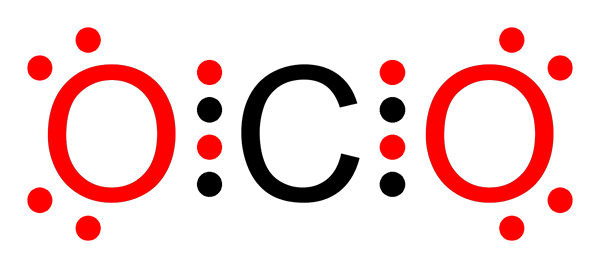
 Icke -polär kovalent bindning av koldioxid
Icke -polär kovalent bindning av koldioxid Vad är en icke -polär kovalent bindning?
En icke -polär kovalent bindning, Även kallad ren eller apolär kovalent bindning, det är föreningen mellan två atomer som delar ett eller flera elektronpar lika lika. Med andra ord.
Denna typ av länk är mellan två lika atomer (av samma element) eller mellan två olika atomer, men som har mycket liknande elektronegativiteter.
Det finns tre typer av kemiska länkar som håller atomerna tillsammans med varandra. Dessa är: den joniska bindningen, den kovalenta bindningen och den metalliska länken. Dessa länkar skiljer sig åt beroende på hur elektroner distribueras runt atomer.
När det gäller kovalenta bindningar delar de två atomerna valenselektronerna, vilket innebär att dessa elektroner, istället för att kretsa kring en atom, kretsa kring de två. Detta är emellertid inte alltid rättvist, eftersom elektroner föredrar att spendera mer tid nära den mest elektronegativa atomen, vilket ger upphov till en polär kovalent bindning.
När det gäller icke -polära kovalenta bindningar händer detta inte, eftersom båda atomerna har samma elektronegativitet eller mycket liknande elektronegativiteter.
Egenskaper för den icke -polära kovalenta länken
1. De bildas mellan atomer med lika eller mycket liknande elektronegativiteter
De är kovalenta länkar som bildas mellan lika atomer eller som har mycket liknande elektronegativiteter. I allmänhet anses en kovalent bindning inte polär om skillnaden mellan elektronegativiteter är mindre än eller lika med 0,4.
Kan tjäna dig: Succinic Acid: Struktur, egenskaper, erhållning, användning2. De kan vara enkla, dubbla eller tredubbla
Beroende på antalet par av elektroner som båda atomerna delar, kan icke -polära eller apolära kovalenta bindningar vara enkla, dubbla eller tredubbla.
När bindningen bildas av ett enda par elektroner kallas det en enkel länk, när två elektronpar delas, kallas det en dubbelbindning, och om tre elektronpar delas, kallas det trippellänk.
3. De involverar nästan alltid icke -metaller
Metaller är element med mycket låga elektronegativiteter som bildar metalllänkar till varandra. När de är kopplade till icke -metaller bildar de alltid antingen jonbindningar eller polära länkar. Av denna anledning bildas icke -polära kovalenta bindningar endast mellan icke -metalliska element som väte och kol.
4. De ger upphov till apolära föreningar
En förening som endast har icke -polära kovalenta bindningar kommer att bildas av apolära molekyler. Dessa typer av föreningar kännetecknas av att ha låga kokning och fusionspunkter jämfört med metaller och joniska föreningar (vissa är till och med gaser vid rumstemperatur), de är olösliga i vatten och är dåliga ledare av värme och elektricitet.
5. De kan bilda fasta, flytande eller gasformiga föreningar vid rumstemperatur
Föreningar med icke -polära kovalenta bindningar kan ha låga men mycket varierande kokning och fusionspunkter.
På grund av detta är några av dem gaser vid rumstemperatur (som väte, h2, och kväve, n2), andra är vätskor (som Bromo, BR2), medan andra är solida (som naftalen, c10H8).
6. De har relativt låga länkenergier.
Jämfört med joniska länkar är icke -polära kovalenta bindningar lättare att bryta, eftersom de har en lägre länkenergi. Detta innebär att du måste använda mindre energi för att bryta en icke -polär kovalent bindning än en jonisk bindning.
Kan tjäna dig: stökiometriska lagarExempel på icke -polära kovalenta länkar
H-H-länk i vätemolekylen (h2)
I vätemolekylen, h2, Två väteatomer delar sina enda valenselektroner för att bilda en enkel kovalent bindning.
 Vätemolekyl
Vätemolekyl Eftersom båda atomerna är desamma kommer skillnaden i elektronegativitet mellan de två att vara noll, så denna länk är en icke -polär kovalent bindning.
F-F-länk i fluormolekylen (F2)
Detta exempel belyser det faktum att det inte spelar någon roll elektronegativiteten hos en atom, men skillnaden i elektronegativitet hos de två atomerna som bildar en länk för att veta om länken kommer att vara kovalent inte polär eller inte.
 Fluormolekyl
Fluormolekyl Fluor är det mest elektronegativa elementet i det periodiska tabellen, så det tenderar att ta bort sina elektroner från de andra elementen för att bilda polära eller joniska bindningar.
Men när en atom av fluorid är kopplad till en annan lika med honom, kan ingen av dem ta bort elektroner från den andra (det finns ingen skillnad i elektronegativitet), så de har inget annat val än att dela dem på ett rättvist sätt och form, därmed form, en icke -polär kovalent länk.
O-O-länkar i ozonmolekylen (eller3)
Liksom i fallet med fluormolekyl är syre också ett mycket elektronegativt element. Men genom att bilda kopplingar till andra syreatomer bildar det icke -polära kovalenta bindningar. Sådan är fallet med ozonmolekylen.
 Ozonmolekyl
Ozonmolekyl I detta fall är den centrala syreatomen kopplad till två andra syreatomer med hjälp av icke -polära eller apolära kovalenta bindningar.
Kan tjäna dig: magnesiumoxid: struktur, egenskaper, nomenklatur, användningN-länk i kvävemolekylen (n2)
Kvävemolekylen innehåller en icke -polär kovalent bindning, där varje kväveatom delar sina tre valenselektroner försvann med den andra.
 Kvävemolekyl
Kvävemolekyl Av denna anledning delar båda atomerna totalt tre par elektroner och bildar således en trippel kovalent bindning.
C-H-länkar i metanmolekylen (CH4)
Metan är ett exempel på en icke -polär kovalent bindning som bildas mellan atomer i olika element, i detta fall kol och väte.
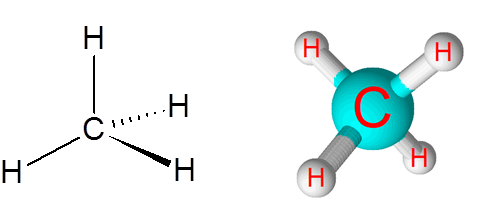 Metanmolekyl
Metanmolekyl Skillnaden i elektronegativitet mellan de två elementen är 0,4 som placerar denna gräns bara mellan de icke -polära och polära bindningarna.
Länk C = C i etylenmolekylen (C2H4)
Etylenmolekylen, även kallad eteno, har totalt fem länkar. Fyra C-H-länkar och en dubbelbindning C = C. I båda fallen motsvarar länkarna icke -polära eller apolära kovalenta bindningar.
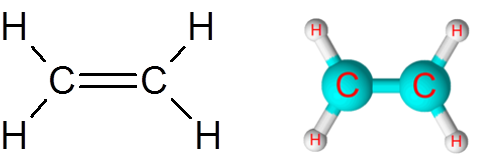 Etylenmolekyl
Etylenmolekyl
- « 6 danser och danser typiska för Quintana Roo mer berömd
- De 9 danserna och typiska danserna av Michoacán mer berömda »

