Kemisk hybridisering

- 1846
- 446
- Anders Svensson
Vad är kemisk hybridisering?
De Kemisk hybridisering Det är "blandningen" av atomorbitaler, vars koncept introducerades av kemisten Linus Pauling 1931 för att täcka bristerna i Valencias länkteori (TEV). Vilka brister? Dessa är: molekylära geometrier och motsvarande länkar i molekyler som metan (CH4).
Enligt TEV bildar de atomiska orbitalerna i C bildar fyra σ -länkar med fyra H -atomer. Orbitalerna 2p, med former av ∞ (lägre bild) av C är vinkelrätt mot varandra, så H bör tas bort från varandra i en vinkel på 90º.

Dessutom är 2s (sfäriska) orbital. Men experimentellt har det visat sig att vinklarna i ch4 De är 109,5º och det är dessutom längden på C-H-länkarna likvärdiga.
För att förklara detta måste en kombination av ursprungliga atomorbitaler anses bilda fyra degenererade hybridorbitaler (av lika energi). Här spelar kemisk hybridisering. Hur är hybrid orbitaler? Det beror på atomorbitalerna som genererar dem. De uppvisar också en blandning av dessa elektroniska egenskaper hos dessa.
Sp3
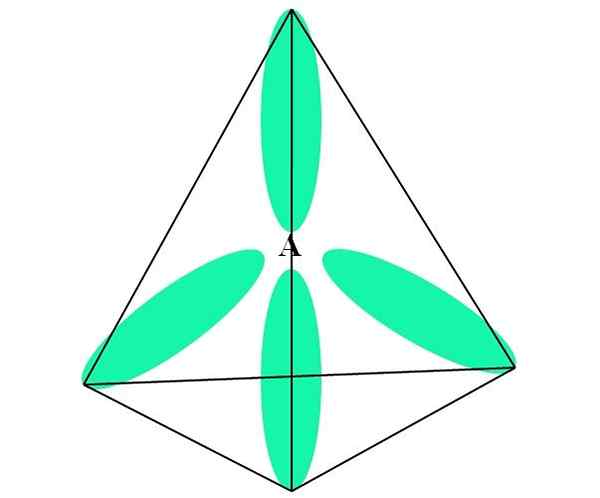
När det gäller ch4, C Hybridisering är SP3. Från detta tillvägagångssätt förklaras molekylär geometri med fyra SP -orbitaler3 Separerad vid 109,5º och pekar mot toppen av en tetrahedron.
I den övre bilden kan du se hur orbitalerna SP3 (grön) Upprätta en tetraedral elektronisk miljö runt atomen (A, som är C för Ch4).
Kan tjäna dig: aminerVarför 109,5º och inte andra vinklar, för att "rita" en annan geometri? Anledningen beror på att denna vinkel minimerar de elektroniska avstötningarna av de fyra atomerna som är kopplade till.
På detta sätt Cho's Molecule4 Det kan representeras som en tetrahedron (tetraedral molekylgeometri).
Om C bildade kopplingen till andra grupper av atomer, vad skulle dess hybridisering då vara i stället för H? Under förutsättning att kolformuläret är fyra länkar σ (C-A) kommer dess hybridisering att vara SP3.
Det kan konsekvent antas att i andra organiska föreningar såsom Ch3Åh, CCL4, C (ch3)4, C6H12 (Cyclohexan), etc., Kol har en SP -hybridisering3.
Detta är viktigt för att skissa organiska strukturer, där kol med enkla länkar representerar divergenspunkter; det vill säga strukturen förblir inte i ett enda plan.
Tolkning
Vad är den enklaste tolkningen för dessa hybrid orbitaler utan att ta itu med matematiska aspekter (vågfunktioner)? Orbitalerna sp3 De antyder att de har sitt ursprung av fyra orbitaler: en och tre p.
Eftersom kombinationen av dessa atomorbitaler ska vara idealiska, är de fyra SP -orbitalerna3 Resultat är identiska och ockuperar olika orienteringar i rymden (till exempel i orbitalerna Px, poch Och sz).
Ovanstående är tillämpligt för resten av de möjliga hybrideringarna: antalet hybridorbitaler som bildas är detsamma som för atomorbitalerna som kombineras. Till exempel SP Híbridos orbital3d2 De är bildade av sex atomiska orbitaler: en S, tre P och två D.
Avvikelser från länkvinklar
Enligt repulsionsteorin om elektroniska par i Valencia -lagret (RPECV) upptar ett par fria elektroner mer volym än en länkad atom. Detta får länkarna att flytta bort, minska elektronisk spänning och avleda vinklarna på 109,5º:
Det kan tjäna dig: Cruise for Crucible: Egenskaper, funktioner, använda exempel
Till exempel i vattenmolekylen är atomerna i H kopplade till orbitalerna sp3 (i grönt), och även paren av elektroner som inte delas ":" Ockupera dessa orbitaler.
Avstötningarna av dessa elektronpar representeras vanligtvis som "två ballonger med ögon", som på grund av deras volym avvisar de två länkarna σ o-h.
I vattnet är således länkvinklarna verkligen 105º, istället för de 109,5º som förväntas för tetraedral geometri.
Vad geometri har då2ANTINGEN? Har en vinkelgeometri. Därför att? För medan elektronisk geometri är tetraedralt, snedvrider inte två par delade elektroner till en vinkelmolekylgeometri.
Sp2
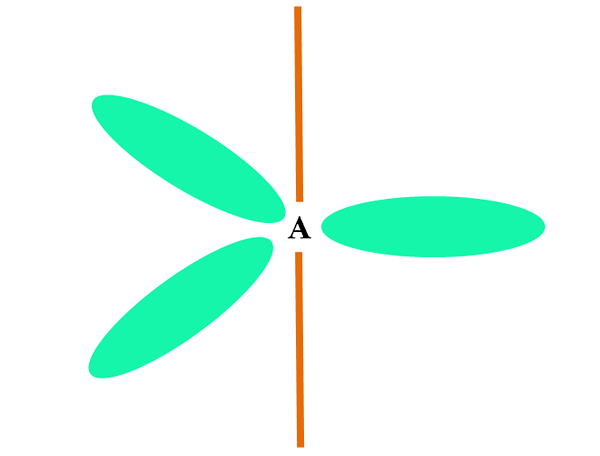
När en atom kombinerar två eller S -orbitaler genererar den tre hybrid orbitaler SP2; En orbital P (eftersom det finns tre) förblir emellertid oförändrad, som representeras som en orange bar i den övre bilden.
Här är de tre orbitalerna SP2 De är gröna för att lyfta fram sin skillnad från Orange Bar: The Orbital P "Pure".
En atom med SP -hybridisering2 Det kan visualiseras som ett trigonalt platt golv (triangeln ritad med SP -orbitalerna2 grönt), med sina vertikaler separerade med 120 ° vinklar och vinkelrätt mot en stång.
Och vilken roll spelar det omloppet rena rena spelet? För att bilda en dubbelbindning (=). Orbitalerna sp2 De tillåter bildning av tre länkar σ, medan den orbital rena p -bindningen π (en dubbel eller trippel länk involverar en eller två länkar π).
Till exempel för att rita karbonylgruppen och strukturen för formaldehydmolekylen (h2C = o) fortsätter det på följande sätt:
Det kan tjäna dig: Cycopropane (C3H6)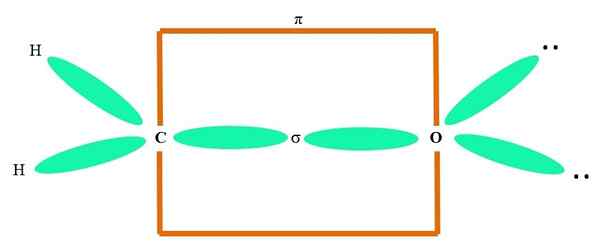
Orbitalerna sp2 Både C och O av O bildar en länk σ, medan dess rena orbitaler bildar en π -bindning (den orange rektangeln).
Det kan märkas hur resten av de elektroniska grupperna (H -atomer och par av inte delade elektroner) finns i de andra SP -orbitalerna2, separerad med 120º.
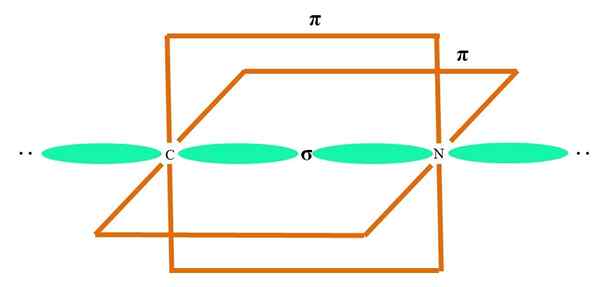
Sp
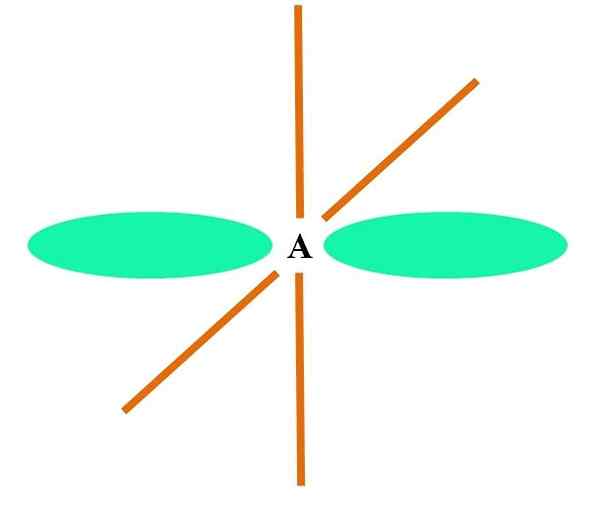
I den överlägsna bilden illustreras en atom med SP -hybridisering. Här en orbital s och en orbital p. Två rena omloppsbanor är emellertid nu oförändrade, vilket gör att de kan bilda två dubbla länkar eller en trippellänk (≡).
Med andra ord: om i en struktur A C uppfyller ovanstående (= C = O C≡C) är dess hybridisering SP. För andra mindre illustrativa atomer - som övergångsmetaller - är beskrivningen av elektroniska och molekylära geometrier komplicerad eftersom orbitalerna D och till och med F beaktas också.
Hybrid orbitaler separeras i en vinkel på 180º. Av denna anledning är de länkade atomerna arrangerade i en linjär molekylgeometri (B-A-B). Slutligen, i den nedre bilden, kan cyanidanjonstrukturen ses: