Vätehistoria, struktur, egenskaper och användningsområden

- 5000
- 691
- Erik Eriksson
han väte Det är ett kemiskt element som representeras av symbol h. Hans atom är den minsta av alla och den är med vilken periodisk tabell börjar, oavsett var han är placerad. Den består av en färglös gas som består av diatomiska molekyler av h2, och inte för isolerade atomer av H; som med de ädla gaserna han, NE, AR, bland andra.
Av alla element är det kanske den mest emblematiska och markerade, inte bara för dess egenskaper i markbundna eller drastiska förhållanden, utan för dess enorma överflöd och variation av dess föreningar. Väte är en gas, även om den är inert i frånvaro av eld, brandfarligt och farligt; Medan vatten, h2Eller det är det universella lösningsmedlet och livet.
 Röda cylindrar som används för att lagra väte. Källa: Famartin [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Röda cylindrar som används för att lagra väte. Källa: Famartin [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Av sig själv visar väte ingen visuell egenhet som är värd att beundra, helt enkelt vara en gas som lagras i röda cylindrar eller nav. De är emellertid dess egenskaper och förmåga att länka till alla element, som återgår till speciellt väte. Och allt detta, även om det bara har en elektron från Valencia.
Om väte inte lagras i deras respektive cylindrar, skulle det undkomma utrymmet medan en stor del reagerar i uppstigningen. Och även om det har en mycket låg koncentration i luften vi andas, utanför jorden och i resten av universum är det det vanligaste elementet, som är i stjärnorna och betraktade sin byggenhet.
På jorden, å andra sidan, representerar det cirka 10% av dess totala massa. För att visualisera vad detta betyder bör det anses att planetens yta är praktiskt täckt med hav och att väte finns i mineraler, i oljeolja och i alla organiska föreningar, förutom att vara en del av alla levande varelser.
Som kol, alla biomolekyler (kolhydrater, proteiner, enzymer, DNA, etc.) De har väteatomer. Därför finns det många källor att extrahera eller producera det; Men få representerar riktigt lönsamma produktionsmetoder.
[TOC]
Historia
Identifiering och namn
Även om Robert Boyle för första gången 1671 bevittnade en gas som bildades när järnfiler reagerade med syror, var den brittiska forskaren Henry Cavendish, 1766, som identifierade honom som ett nytt ämne; Den "brandfarliga luften".
Cavendish fann att när denna påstådda brandfarliga luft brände, genererades vatten. Baserat på hans arbete och resultat gav den franska kemisten Antoine Lavoisier denna gas namnet på väte 1783. Etymologiskt härrör dess betydelse från de grekiska orden 'hydro' och 'gener': vattenformator.
Elektrolys och bränsle
Strax efter 1800 upptäckte de amerikanska forskarna William Nicholson och Sir Anthony Carlisle att vatten kan sönderdelas till väte och syre; hade hittat vattenelektrolys. Därefter introducerade den schweiziska kemisten Christian Friedrich Schoenbein idén att dra fördel av väteförbränning för att generera elektricitet.
Vätes popularitet var så mycket att till och med författaren Julio Verne hänvisade till det som ett framtidsbränsle i sin bok Den mystiska ön (1874).
Isolering
1899 var den skotska kemisten James Dewar den första som isolerade väte som flytande gas, var själv som kunde svalna den nog för att få den i sin solida fas.
Två kanaler
Från denna punkt presenterar vätehistorien två kanaler. Å ena sidan är dess utveckling inom bränslen och batterierna; Och å andra sidan, förståelsen för strukturen i hans atom och hur han representerade elementet som öppnade dörrarna för kvantfysik.
Elektronisk struktur och konfiguration
 Kiselväte. Källa: Benjah-Bmm27 [Public Domain]
Kiselväte. Källa: Benjah-Bmm27 [Public Domain] Väteatomer är mycket små och har knappt en elektron för att bilda kovalenta bindningar. När två av dessa atomer samlas, ger de upphov till en diatomisk molekyl, h2; Detta är gasmolekylärt väte (överlägsen bild). Varje vit sfär motsvarar en individuell H -atom och den globala sfären till molekylära orbitaler.
Således består väte verkligen av H -molekyler2 Mycket liten som interagerar genom London -spridningskrafter, eftersom de saknar ett dipolmoment för att vara homonukleära. Därför är de väldigt "rastlösa" och sprids snabbt i rymden eftersom det inte finns några starka intermolekylära krafter för att bromsa dem.
Den elektroniska vätekonfigurationen är helt enkelt 1s1. Denna orbital, 1s, är produkten av upplösningen av den berömda Schrödinger -ekvationen för väteoidatomen. I H2 Två 1S -orbitaler överlappar varandra för att bilda två molekylära orbitaler: en av länkar och en annan av antienlace, enligt Molecular Orbital Theory (TOM).
Dessa orbitaler tillåter eller förklarar förekomsten av hjoner2+ eller h2-; Vätekemi definieras emellertid under normala förhållanden av h2 eller jonerna h+ eller h-.
Oxidationsnummer
Från den elektroniska konfigurationen för väte, 1s1, Det är mycket lätt att förutsäga dess möjliga oxidationsnummer; Att vara i åtanke, naturligtvis, att orbital 2s av större energi inte är tillgänglig för kemiska länkar. I basaltillstånd har således väte ett oxidationsnummer på 0, h0.
Det kan tjäna dig: nickelhydroxid (ii): struktur, egenskaper, användningar, riskerOm du tappar din enda elektron är 1s orbital tom och katjonen eller vätejonen bildas, h+, av stor rörlighet i nästan alla flytande medium; särskilt vatten. I detta fall är oxidationsnumret +1.
Och för när det motsatta händer, det vill säga att vinna en elektron, kommer Orbital nu att ha två elektroner och kommer att vara 1s2. Då är oxidationsnumret -1 och motsvarar hydridanjonen, h-. Det är värt att notera att h- Han är isolektronisk för ädla heliumgas, han; det vill säga båda arter har samma antal elektroner.
Sammanfattningsvis är väteoxidationsnummer: +1, 0 och -1 och H -molekylen2 räknas som om de hade två väteatomer h0.
Faser
Vätfasen av väte, åtminstone under markförhållanden, är soda på grund av de tidigare angivna skälen. Men när temperaturen minskar i storleksordningen -200 ºC, eller om trycket ökar hundratusentals gånger än atmosfäriskt, kan väte kondensera eller kristallisera i en vätska respektive fast fas.
Under dessa förhållanden2 De kan anpassa sig till olika sätt att definiera strukturella mönster. London -spridningskrafter blir nu mycket riktade och därför dyker upp geometrier eller symmetrier som antagits av kamrater2.
Till exempel två hsses h2, Det är som att skriva (h2)2 Definiera ett symmetriskt eller asymmetriskt fyrkant. Under tiden tre par h2, eller (h2)3 De definierar en hexagon, mycket lik kol i grafitkristaller. I själva verket är denna hexagonala fas den viktigaste eller mest stabila för fast väte.
Men vad händer om det fasta ämnet inte komponerades från molekyler utan av h? Då skulle vi ta itu med metalliskt väte. Dessa H -atomer, som kommer ihåg de vita sfärerna, kan definiera både en flytande fas och ett metalliskt fast ämne.
Egenskaper
Fysiskt utseende
Väte är en färglös, luktlös och smaklös gas. Därför, om det finns en läcka representerar en risk för explosion.
Kokpunkt
-253 ºC.
Smältpunkt
-259 ºC.
Tändpunkt och stabilitet
Praktiskt taget exploderar det vid vilken temperatur som helst om det finns en gnista eller värmekälla nära gas, till och med solljus kan avfyra väte. Men så länge det är väl lagrat är det lite reaktiv gas.
Densitet
0,082 g/L. Är 14 gånger lättare än luft.
Löslighet
1,62 mg/L vid 21 ºC i vatten. Det är i allmänhet olösligt i de flesta vätskor.
Ångtryck
1,24 · 106 mmHg vid 25 ºC. Detta värde ger en uppfattning om hur stängt vätecylindrarna måste vara för att förhindra att gas flyr från.
Självriktningstemperatur
560VºC.
Elektronnegativitet
2.20 på Pauling -skalan.
Förbränningsvärme
-285,8 kJ/mol.
Förångningsvärme
0,90 kJ/mol.
Fusionsvärme
0,117 kJ/mol.
Isotoper
Den "normala" väteatomen är protioen, 1H, som utgör cirka 99.985% av väte. De andra två isotoperna för detta element är deuterium, 2H och tritium, 3H. Dessa skiljer sig åt i antalet neutroner; Deuterium har en neutron, medan tritio har två.
Ryggar isomerer
Det finns två typer av molekylväte, h2: Orto och för. I de första är de två snurrarna (av protonen) hos H -atomerna inriktade på samma riktning (de är parallella); Medan de andra är de två snurrarna i motsatta riktningar (de är antiparallella).
Väte-för är den mest stabila av de två isomererna; Men genom att öka temperaturen, dominerar Ortho-förhållandet: att bli 3: 1, vilket innebär att vätorganisomeren dominerar över den andra. Vid mycket låga temperaturer (fjärrstyrning nära absolut noll, 20k), rent väte-för.
Nomenklatur
Nomenklaturen för att hänvisa till väte är en av de enklaste; Även om det inte är på samma sätt för deras oorganiska eller organiska föreningar. H2 Det kan kallas med följande namn utöver "väte":
-Molekylväte
-Dihydrogen
-Kiselväte.
För jon h+ Deras namn är proton- eller vätejon; Och om det är i vattenhaltigt medium, h3ANTINGEN+, Hydroniumkation. Medan jon h- Det är hydridanjonen.
Väteatomen
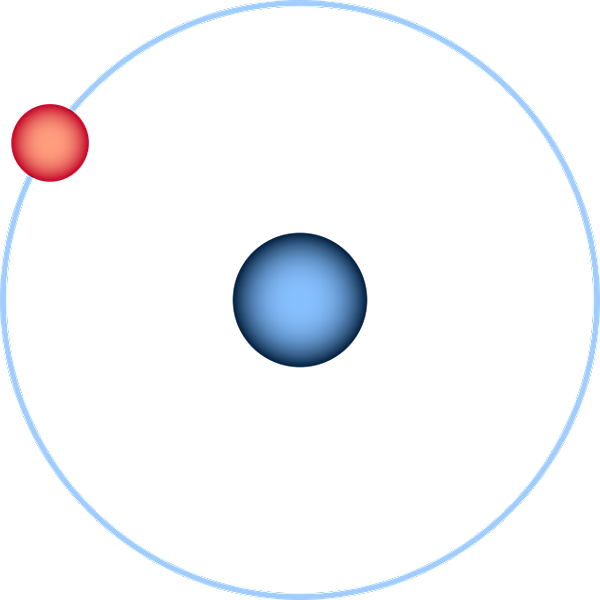 Väteatomen representerad genom Bohrs planetmodell. Källa: Pixabay.
Väteatomen representerad genom Bohrs planetmodell. Källa: Pixabay. Väteatomen är den enklaste av alla och representeras vanligtvis som i den överlägsna bilden: en kärna med en proton ensam (för 1H), omgiven av en elektron som drar en bana. På denna atom har alla atomiska orbitaler för de andra elementen i det periodiska bordet byggts och uppskattats.
En mer lojal representation för den nuvarande förståelsen av atomer skulle vara en sfär vars periferi definieras av elektroniska och sannolikmoln i elektron (dess 1S -orbital).
Kan tjäna dig: termisk: struktur, egenskaper, bildning, exempelVar är och produktion
 A Stars Field: Outtömlig vätekälla. Källa: Pixabay.
A Stars Field: Outtömlig vätekälla. Källa: Pixabay. Väte är, även om det kanske i mindre utsträckning jämfört med kol, det kemiska elementet som kan sägas utan tvekan som är överallt; I luften, utöver vattnet som fyller hav, hav och våra kroppar, i olje -råolja och mineraler, såväl som i de organiska föreningarna som är monterade för att komma från livet.
Det räcker för att ytligt titta på alla sammansatta bokhandel för att hitta väteatomer i dem.
Frågan ligger i inte så mycket hur mycket men hur den är närvarande. Till exempel M -molekylen2 Det är så flyktigt och reaktivt under förekomsten av solstrålar, vilket är mycket knappt i atmosfären; Därför reagerar den att gå med i andra element och därmed få stabilitet.
Medan ovan, i kosmos, är väte främst som neutrala atomer, h.
I själva verket beaktas väte i sin metall och kondenserade fas, såsom stjärnkonstruktionsenheten. När det finns oändliga mängder av dem och på grund av deras robusthet och kolossala dimensioner gör de detta element till det vanligaste av hela universum. Det uppskattas att 75% av det kända ämnet motsvarar väteatomer.
Naturlig
Samla atomerna av lösa hydrogener i rymden låter oförändrade och extrahera dem från solens periferier, eller av de nebulösa, ouppnåliga. På jorden, där dess förhållanden tvingar detta element att existera som h2, Det kan ske genom naturliga eller geologiska processer.
Väte har till exempel sin egen naturliga cykel där vissa bakterier, mikrober och alger kan generera det genom fotokemiska reaktioner. Upptrappningen av naturliga processer och paralleller till dessa inkluderar användning av bioreaktorer, där bakterier matas på kolväten för att frigöra väte som finns i dem.
Levande varelser är också väteproducenter, men i mindre utsträckning. Om så är fallet, kunde det inte förklaras hur en av de gasformiga komponenterna i flatulens utgör; som har visat för mycket att de är brandfarliga.
Slutligen är det värt att nämna att under anaeroba förhållanden (utan syre), till exempel i underjordiska skikt, kan mineraler långsamt reagera med vatten för att producera väte. Fayelitas reaktion visar det:
3Fe2Sio4 + 2 h2O → 2 tro3ANTINGEN4 + 3 sio2 + 3 h2
Industriell
Medan biohydrogen är ett alternativ för att generera denna gas på industriella skalor, är de mest använda metoderna praktiskt taget "att" ta bort "väte till föreningarna som innehåller det, så att deras atomer sammanfogas och bildar H2.
De minsta miljömetoderna för att producera den består av att reagera koks (eller kol) med överhettad vattenånga:
C (s) + h2O (g) → Co (g) + h2(g)
På samma sätt har naturgas använts för detta ändamål:
Ch4(g) + h2O (g) → Co (g) + 3h2(g)
Och eftersom mängden koks eller naturgas är stora är det lönsamt att producera väte av någon av dessa två reaktioner.
En annan metod för att få väte är att applicera en elektrisk chock på vattnet för att sönderdelas i dess elementära delar (elektrolys):
2 h2Eller (l) → 2 h2(g) + eller2(g)
På laboratoriet
I alla laboratorier kan molekylärt väte framställas i små mängder. För att göra detta bör en aktiv metall reageras med en stark syra, antingen i en bägare eller i ett provrör. Den observerbara bubblan är ett tydligt tecken på vätebildning, representerad av följande allmänna ekvation:
M (s) + nh+(AC) → Mn+(Ac) + h2(g)
Där n är metallen Valencia. Således reagerar magnesium med H+ Att producera h2:
Mg (s) + 2h+(AC) → MG2+(Ac) + h2(g)
Reaktioner
Rédox
Oxidationsnummer själva erbjuder ett första tillvägagångssätt för hur väte deltar i kemiska reaktioner. H2 När du reagerar kan det förbli oförändrat eller dela på hjonerna+ eller h- beroende på vilka arter den kopplar; Om de är mer eller mindre elektronegativa än honom.
H2 Det är lite reaktivt på grund av styrkan hos dess kovalenta bindning, H-H; Detta är emellertid inte ett absolut hinder för att reagera och bilda föreningar med nästan alla element i det periodiska tabellen.
Dess mest kända reaktion är med syregas för att producera vattenångor:
H2(g) + eller2(g) → 2h2O (g)
Och det är en sådan affinitet för syre att bilda den stabila vattenmolekylen, som till och med kan reagera med den som anjon eller2- I vissa metalloxider:
H2(g) + Cuo (S) → CU (S) + H2Eller (l)
Även silveroxid reagerar eller "minskar" genom samma reaktion:
H2(g) + aug (s) → Ag (s) + h2Eller (l)
Dessa vätereaktioner motsvarar de av Rédox -typ. Det vill säga reduktionsoxidation. Väte oxiderar både i närvaro av syre- och metalloxider av mindre reaktiva metaller än honom; Till exempel koppar, silver, volfram, kvicksilver och guld.
Absorption
Vissa metaller kan absorbera gasformigt väte för att bilda metallhydror, som betraktas som om de var legeringar. Till exempel absorberar övergångsmetaller som paladium ökända mängder av H2, liknar metallsvampar.
Kan tjäna dig: Neodymium: Struktur, egenskaper, användningarDetsamma händer med mer komplexa metalllegeringar. På detta sätt kan väte lagras på andra sätt utöver dess cylindrar.
Tillägg
Organiska molekyler kan också "absorbera" väte genom molekylära mekanismer och/eller olika interaktioner.
För metaller, H -molekyler2 De är omgiven av metallatomer inuti sina kristaller; Medan de är i organiska molekyler bryts H-H-bindningen för att bilda andra kovalenta bindningar. I en mer formaliserad mening: Väte absorberas inte, men läggs till strukturen.
Det klassiska exemplet är tillägget av h2 att fördubbla eller tredubbla länk av alkener eller alkiner, respektive:
C = c + h2 → H-C-C-H
C≡C + H2 → HC = CH
Dessa reaktioner ges också namnet på hydrering.
Hydrosbildning
Väte reagerar direkt på elementen för att bilda en familj av kemiska föreningar som kallas hydros. Det finns främst två typer: Salino och molekylär.
Det finns också metallhydrorer, som består av metalllegeringar som redan nämnts när dessa metaller absorberar gasformigt väte; och polymeren, med nätverk eller kedjor av E-H-bindningar, där det betecknar det kemiska elementet.
Salino
I saltlösningshydror deltar väte i den joniska bindningen såsom hydridanjon, h-. För att detta ska bildas måste elementet nödvändigtvis vara mindre elektronegativt; Annars skulle det inte ge upp sina elektroner till väte.
Därför bildas salthydros endast när väte reagerar med mycket elektropositiva metaller, såsom alkaliska och alkaliners.
Väte reagerar till exempel med metalliskt natrium för att producera natriumhydrid:
2na (s) + h2(g) → 2nah (er)
Eller med barium för att producera bariumhydrid:
Ba (s) + h2(g) → bah2(S)
Molekyl
Molekylära hydrider är ännu bättre kända än joniska. De får också namnet på vätehalogenuros, HX, när väte reagerar med en halogen:
Kli2(g) + h2(g) → 2HCl (g)
Här deltar väte i den kovalenta bindningen som h+; Sedan är skillnaderna mellan elektronegativiteterna mellan båda atomerna inte så stora.
Samma vatten kan betraktas som en syrehydrid (eller väteoxid), vars bildningsreaktion redan exponerades. Mycket lika är reaktionen med svavel för att ge vätesulfid, en illaluktande gas:
S (s) + h2(g) → h2S (g)
Men av alla molekylära hydrorer är de mest kända (och kanske de svåraste att syntetisera) ammoniak:
N2(g) + 3h2(g) → 2NH3(g)
Ansökningar
I föregående avsnitt behandlades redan en av de viktigaste användningarna av väte: som råmaterial för utveckling av syntes, oorganiskt eller organiskt. Att kontrollera denna gas har vanligtvis ett annat syfte än att få den att reagera för att skapa andra föreningar som skiljer sig från de som extraherades.
Råmaterial
- Det är en av reagensen för syntesen av ammoniak, som i sin tur har oändliga industriella tillämpningar, med början med utarbetandet av gödselmedel, tills det är material för kväveläkemedel.
- Det är avsett att reagera med kolmonoxid och därmed producera metanol, ett reagens som innehåller mycket biobränslen.
Reduktionsmedel
- Det är ett reducerande medel för vissa metalloxider, så det används vid metallurgisk reduktion (redan förklaras i fallet med koppar och andra metaller).
- Minska fetter eller oljor för att producera margarin.
Oljeindustri
Inom oljeindustrin används väte för att "hydrotratar" olje råolja i förfiningsprocesser.
Till exempel försöker den fragmentera stora och tunga molekyler i små molekyler och med större efterfrågan på marknaden (Hydrocracheus); frisläppande metaller fångade i petroporfirinburar (hydrodesmetalisering); eliminera svavelatomer som h2S (hydrodesulfurization); eller minska dubbla länkar för att skapa rika blandningar i paraffiner.
Bränsle
Väte i sig är ett utmärkt bränsle för raketer eller rymdskepp, eftersom små mängder av det reagerar med syre, de släpper enorma mängder värme eller energi.
I mindre skala används denna reaktion för utformning av celler eller vätebatterier. Dessa celler möter emellertid svårigheterna med att inte kunna lagra denna gas ordentligt; och utmaningen med helt oberoende av brinnande fossila bränslen.
På den positiva sidan, som används som bränsle, frigör väte endast vatten; I stället för gaser som representerar föroreningar för atmosfären och ekosystemen.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Hanyu Liu, Li Zhu, Wenwen Cui och Yanming MA. (s.F.). Rumstemperaturstrukturer av fast väte vid högt tryck. State Key Lab of Superhard Materials, Jilin University, Changchun 130012, China.
- Pierre-Marie Robitaille. (2011). Flytande metallväte: En byggsten för vätskesolen. Institutionen för radiologi, Ohio State University, 395 W. 12th Ave, Columbus, Ohio 43210, USA.
- Bodner Group. (s.F.). Vätekemi. Hämtad från: Chemed.Kem.Purdu.Edu
- Wikipedia. (2019). Väte. Hämtad från: i.Wikipedia.org
- Väteuropa. (2017). Väteapplikationer. Återhämtad från: hydgeneureop.Eu
- Foist Laura. (2019). Väte: Egenskaper och förekomst. Studie. Återhämtat sig från: studie.com
- Jonas James. (4 januari 2009). Väteshistoria. Hämtad från: AltenergyMag.com
- « Pichincha stridsorsaker, konsekvenser och karaktärer
- Pastorala nya egenskaper, representanter, verk »

