Litiumhydridstruktur, egenskaper, erhållning, användning
- 2952
- 196
- PhD. Emil Svensson
han Litiumhydrid Det är ett kristallint oorganiskt fasta ämnen vars kemiska formel är lih. Det är det mest lätta oorganiska saltet, dess molekylvikt är bara 8 g/mol. Det bildas av föreningen av en litiumjon li+ och en hydridhjon-. Båda är förenade av en jonisk bindning.
Lih har en hög smältpunkt. Det reagerar lätt med vatten och i reaktionen inträffar vätgas. Det kan erhållas genom reaktion mellan smält litiummetall och vätgas. Det används ofta i kemiska reaktioner för att få andra hydrorer.
 Litiumhydrid, lih. Ingen maskinläsbar författare tillhandahållen. Jtiago antas (baserat på upphovsrättsanspråk). [Allmängods]. Källa: Wikimedia Commons.
Litiumhydrid, lih. Ingen maskinläsbar författare tillhandahållen. Jtiago antas (baserat på upphovsrättsanspråk). [Allmängods]. Källa: Wikimedia Commons. Lih har använts för att skydda mot farlig strålning såsom de som finns i kärnreaktorer, dessa är, alfa, beta, gammastrålning, protoner, x -rays och neutroner.
Det har också föreslagits för skyddet av materialen i rymdraketerna som flyttas av kärntermisk framdrivning. Studier används till och med för att användas som ett skydd för människan mot kosmisk strålning under framtida resor till planeten Mars.
[TOC]
Strukturera
I litiumhydrid har väte en negativ belastning h-, Tja, en elektron har stal till metallen, som är i form av jon li+.
Elektronisk katjonkonfiguration li+ Det är: [han] 1s2 vilket är mycket stabilt. Och den elektroniska strukturen hos hydrid h- Det är: 1s2, vilket också är mycket stabilt.
Katjonen och anjonen binder av elektrostatiska krafter.
Litiumhydridkristallen har samma struktur som natriumkloriden, det vill säga en kubisk kristallin struktur.
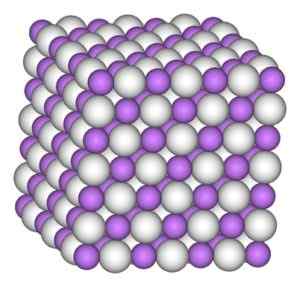 Kubisk kristallin struktur av litiumhydrid. Författare: Benjah-Bmm27. Källa: Wikimedia Commons.
Kubisk kristallin struktur av litiumhydrid. Författare: Benjah-Bmm27. Källa: Wikimedia Commons. Nomenklatur
- Litiumhydrid
- Lih
Egenskaper
Fysiskt tillstånd
Vit eller färglöst kristallint fast ämne. Kommersiell lih kan vara gråaktig blå på grund av närvaron av små mängder litiummetall.
Molekylvikt
8 g/mol
Smältpunkt
688 ºC
Kokpunkt
Det sönderdelas vid 850 ºC.
Självriktningstemperatur
200 ºC
Densitet
0,78 g/cm3
Löslighet
Reagera med vatten. Det är olösligt i etrar och kolväten.
Andra egenskaper
Litiumhydrid är mycket mer stabil än hydroerna för de andra alkaliska metallerna och kan smälts utan nedbrytning.
Kan servera dig: torrt batteriDet påverkas inte av syre om det värms upp vid temperaturer under rött. Det påverkas inte heller av klor CL2 och HCL -saltsyra.
LIH -kontakt med värme och fuktighet orsakar en exoterm reaktion (genererar värme) och väteutveckling h2 och litiumhydroxidlioh.
Det kan bilda ett fint damm som kan utnyttja i kontakt med lågor, värme eller oxiderande material. Du bör inte kontakta kväveoxid eller flytande syre, eftersom det kan utnyttja eller slå på.
Det mörknar genom att bli utsatt för ljus.
Erhållande
Litiumhydrid har erhållits i laboratoriet genom reaktion mellan smält litiummetall och vätgas vid en temperatur av 973 K (700 ° C).
2 li + h2 → 2 Lih
Bra resultat erhålls när den utsatta ytan på det smälta litiumet ökas och när lih -sedimentationstiden reduceras. Det är en exoterm reaktion.
Jag använder som en skyddande sköld mot farlig strålning
Lih presenterar en serie egenskaper som gör det attraktivt att användas som skydd för människa i kärnreaktorer och rymdsystem. Här är några av dessa egenskaper:
- Det har ett högt väteinnehåll (12,68 viktprocent H) och ett stort antal väteatomer per enhetsvolym (5,85 x 1022 H/CM -atomer3).
- Dess höga smältpunkt gör att den kan användas i miljöer med hög temperatur utan att grundas.
- Det har ett lågt dissocieringstryck (~ 20 torr vid sin smältpunkt) som gör att materialet kan gjutas och frysas utan nedbrytning under lågt vätepress.
- Den har en låg densitet som gör det attraktivt att användas i rymdsystem.
- Men deras nackdelar är deras låga värmeledningsförmåga och dåliga mekaniska egenskaper. Men detta har inte minskat dess tillämpbarhet.
- Lih -bitar som fungerar som sköldar tillverkas av kall eller varm pressning och av fusion och häller i formar. Även om denna sista form föredras.
- Vid rumstemperatur skyddas delarna från vatten- och vattenånga.
- I kärnreaktorer
I kärnreaktorer finns det två typer av strålning:
Kan tjäna dig: syror och baser i vardagen: reaktioner, användningar, exempelDirekt joniserande strålning
De är mycket energipartiklar som bär elektrisk laddning, såsom alfa (α) och beta (ß) och protonpartiklar. Dessa typer av strålning interagerar mycket starkt med sköldarnas material, vilket orsakar jonisering när man interagerar med elektronerna i materialen i materialen genom vilka de passerar.
Indirekt joniserande strålning
De är neutroner, gammastrålar (γ) och x -rayser, som är trängande och kräver massskydd, eftersom de involverar utsläpp av laddade sekundära partiklar, som är de som orsakar jonisering.
 Symbol för att varna för farlig strålning. IAEA & ISO [Public Domain]. Källa: Wikimedia Commons.
Symbol för att varna för farlig strålning. IAEA & ISO [Public Domain]. Källa: Wikimedia Commons. Enligt vissa källor är LIH effektiv för att skydda material och människor mot dessa typer av strålning.
- I kärnvärmeavdrivningssystem
Lih har nyligen valts ut som en potentiell moderator och skyddsmaterial mot kärnkraftstrålning för kärntermiska framdrivningssystem för rymdskepp för mycket långa resor.
 Konstnärlig representation av rymdfordon med kärnkraftsdrivning i Mars -bana. NASA/SAIC/PAT RAWLINGS [Public Domain]. Källa: Wikimedia Commons.
Konstnärlig representation av rymdfordon med kärnkraftsdrivning i Mars -bana. NASA/SAIC/PAT RAWLINGS [Public Domain]. Källa: Wikimedia Commons. Dess låga densitet och höga väteinnehåll orsakar massan och volymen för kärnkraftsdrivningsreaktorn att effektivt minska.
- I skydd mot kosmisk strålning
Exponering för rymdstrålning är den viktigaste risken för människors hälsa i framtida interplanetära utforskningsuppdrag.
I det djupa rymden kommer astronauter att utsättas för det kompletta spektrumet av galaktiska kosmiska strålar (joner med hög energi) och solpartikelutkastningshändelser (protoner).
Faran för strålningsexponering förvärras på grund av uppdragens varaktighet. Dessutom måste skyddet av de platser som upptäcktsresande också övervägas.
 Framtida livsmiljösimulering på Planet Mars. NASA [Public Domain]. Källa: Wikimedia Commons.
Framtida livsmiljösimulering på Planet Mars. NASA [Public Domain]. Källa: Wikimedia Commons. I denna idéordning indikerade en studie som genomfördes 2018 att bland de beprövade materialen ger Lih den högsta strålningsminskningen per gram per cm2, Således är en av de bästa kandidaterna som ska användas för att skydda mot kosmisk strålning. Dessa studier måste dock fördjupas.
Jag använder som ett sätt att lagra och säker vättransport
Få energi från h2 Det är något som har studerats i flera tiotals år och har redan hittat tillämpning för att ersätta fossila bränslen i transportfordon.
Kan tjäna dig: kemisk balans: förklaring, faktorer, typer, exempelH2 Det kan användas i bränsleceller och bidra till minskning av samproduktion2 och intex, därmed undvika växthuseffekten och föroreningar. Ett effektivt system för lagring och transport av H har emellertid ännu inte hittats2 Visst, med lätt, kompakt eller liten vikt, som kör den snabbt och släpper H2 lika snabbt.
Lih litiumhydrid är från alkaliska hydrorer som har den högsta lagringskapaciteten på H2 (12,7 viktprocent h). Release H2 genom hydrolys enligt följande reaktion:
Lih + H2O → LiOH + H2
Lih levererar 0,254 kg väte för varje kg lih. Dessutom har den en hög lagringskapacitet per enhetsvolym, vilket innebär att den är lätt och är ett kompakt medium för H -lagring2.
 Motorcykel vars bränsle är väte lagrat i form av en metallisk hydrid som Lih. ELLER.S. DOE Energy Efficient and Renewable Energy (USA) [Public Domain]. Källa: Wikimedia Commons.
Motorcykel vars bränsle är väte lagrat i form av en metallisk hydrid som Lih. ELLER.S. DOE Energy Efficient and Renewable Energy (USA) [Public Domain]. Källa: Wikimedia Commons. Dessutom är LiH lättare bildad än andra alkaliska metallhydrorer och är kemiskt stabilt vid miljötemperaturer och tryck. Lih kan transporteras från tillverkaren eller leverantören till användaren. Sedan genom hydrolys av lih genereras H2 Och detta används säkert.
Lioh litiumhydroxid bildad kan returneras till leverantören som regenererar litium genom elektrolys och sedan produceras igen.
Lih har också studerats framgångsrikt för att användas tillsammans med den djärva hydracin för samma syfte.
Användning i kemiska reaktioner
Lih tillåter komplexa hydrorsyntes.
Det tjänar till exempel att framställa litiumtrietylborohydrid är som är en kraftfull nukleofil i organiska halurosförskjutningsreaktioner.
Referenser
- Sato och. Och Takeda, eller. (2013). Vätelagring och transportsystem genom litiumhydrid med smält saltteknik. I smält salter kemi. Kapitel 22, sidorna 451-470. Återhämtat sig från Scientedirect.com.
- ELLER.S. National Library of Medicine. (2019). Litiumhydrid. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov.
- Wang, l. et al. (2019). Undersökning av effekterna av themal-kärneffekt av lichiumhydrid på reaktiv av kärnkraft. Annals of Nuclear Energy 128 (2019) 24-32. Återhämtat sig från Scientedirect.com.
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Giraudo, m. et al. (2018). Acceleratorbaserade tester av skärmningseffekt av olika material och multiyers med hjälp av höge-ery lätta och tunga joner. Strålningsforskning 190; 526-537 (2018). NCBI återhämtade sig.Nlm.Nih.Gov.
- Welch, f.H. (1974). Litiumhydrid: Ett rymdåldersmaterial. Kärnteknik och design 26, 3, februari 1974, sidorna 444-460. Återhämtat sig från Scientedirect.com.
- Simnad, m.T.(2001). Kärnreaktorer: Skyddsmaterial. I Encyclopedia of Materials: Science and Technology (andra upplagan). Sidorna 6377-6384. Återhämtat sig från Scientedirect.com.
- Hügy, T. et al. (2009). Hydrazine Borane: Ett lovande vätgaslagringsmaterial. J. A.M. Kem. Soc. 2009, 131, 7444-7446. Återhämtat sig från pubar.ACS.org.

