Natriumhydroxidstruktur, egenskaper, användningar, syntes

- 967
- 241
- Prof. Erik Johansson
han natriumhydroxid Det är en oorganisk förening vars kemiska formel är NaOH och består av en mycket stark metallbas eller alkali. En lösning på 5 %i vatten har ett pH nära 14.
Det är ett mycket hygroskopiskt vitt fast ämne och som också kan absorbera koldioxid i luften för att bilda natriumkarbonat. Kommersiellt finns i plastflaskor som piller, som inte kan utsättas för mycket tid i luften, och de bör inte heller manipuleras med spatlar.
 Natriumhydroxidpiller på ett klockglas. Källa: Ingen maskinläsbar författare tillhandahållen. Walkerma antas (baserat på upphovsrättsanspråk). [Allmängods]
Natriumhydroxidpiller på ett klockglas. Källa: Ingen maskinläsbar författare tillhandahållen. Walkerma antas (baserat på upphovsrättsanspråk). [Allmängods] Natriumhydroxid kan syntetiseras när man reagerar kalciumhydroxid med natriumkarbonat. För närvarande syntetiseras det grundläggande genom saltlakeelektrolys och är en sekundär produkt av gasklorproduktion.
Ge. Det används också i hemrengöring, vattenbehandling, aluminiumbehandling, medicinstillverkning etc.; Och framför allt är det ett sekundärt mönster par excellence.
Natriumhydroxid är mycket frätande och kan producera irritation och hudförbränningar och ögon. Genom inandning av dess damm kan det orsaka lungödem. Under tiden kan intaget orsaka så allvarliga skador på matsmältningskanalen som kan leda till döden.
[TOC]
Strukturera
Vatten-
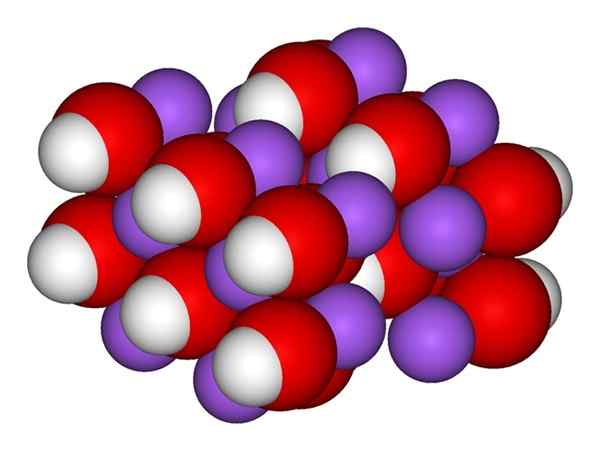
 NaOH -joner. Källa: Gabriel Bolívar.
NaOH -joner. Källa: Gabriel Bolívar. Den överlägsna bilden visar jonerna som utgör NaOH. Na katjonen+ Det representeras av den lila sfären, medan hydroxylanjon (hydroxid eller oxydril) OH- För den röda och vita sfären. Båda najonerna+ och åh- De interagerar med varandra genom den elektrostatiska attraktionen i deras motsatta laster.
 Natriumhydroxidstruktur
Natriumhydroxidstruktur Sådana interaktioner är icke -riktade, så attraktionerna i en jonisk NA+Åh- kan påverka andra på ett visst avstånd. Resultatet är att Na -joner+ De avvisar varandra på samma sätt som OH-, Tills att definiera en minimikristall där de skapar en ordnad och periodisk struktur (kristallin).
Därför verkar ortorrombiska kristaller av NaOH anhydro (utan vatten):
 Representation av den kristallina strukturen hos vattenfri natriumhydroxid. Källa: Quibik via Wikipedia.
Representation av den kristallina strukturen hos vattenfri natriumhydroxid. Källa: Quibik via Wikipedia. Jonerna förblir tillräckligt sammanhängande för naOH -vattenfri kristall till bas 323 ºC (förutsatt att det inte finns någon fukt i miljön).
Hydrater
Båda NA+ Som åh- Det är joner som lätt vattenmolekyler solvetan (hydrat). Detta gynnar sin hydrering över dess retikulära energi i dess kristaller, så NaOH släpper mycket energi när den kommer i kontakt med vatten.
Det kan tjäna dig: Fehling Reaction: Preparations, Active Agents, Exempel, användningarVattenfria kristaller kan emellertid vara värd för vattenmolekyler utan att lösa upp; det vill säga natriumhydroxid kan bilda många hydrater, NaOH · nH2ANTINGEN. Vattenmolekylen kan mycket väl bilda en vätebro med OH- (Hoh-oh-) eller samordna med NA+ (Na+-Åh2).
Beroende på den molära andelen mellan NaOH och h2Eller monohydrater kan uppstå (NaOH · h2O), dihydrater (NaOH · 2h2O), trihemakrater (NaOH · 3.5 timmar2O), tetrahydrater (NaOH · 4h2O), heptahridates (NaOH · 7h2O) och andra.
Var och en av dessa hydrater kan kristallisera från en vattenhaltig NaOH -lösning med olika massprocent och vid olika temperaturer. Följaktligen uppvisar NaOH ett komplicerat vattenlöslighetsdiagram.
I allmänna termer är hydrater kristaller mindre täta och har lägre smältpunkter. Detta beror på att vattenmolekylerna "hindrar" interaktioner mellan NA+ och åh-, Lägga till dipol-dipolkrafter i uppoffring av joniska attraktioner.
Fysiska och kemiska egenskaper
Namn
IUPAC Föredraget namn: natriumhydroxid. Andra namn: kaustisk soda, ascarita (mindre vanligt)
Molmassa
39.9971 g/mol
Utseende
Fast eller vit, serös eller ogenomskinlig kristaller.
Smältpunkt
323 ºC
Kokpunkt
1.388 ºC
Vattenlöslighet
1.000 g/L vid en temperatur av 25 ºC. Detta visar hur mycket det kan upplösas i vatten.
Dess vattenhaltiga lösningar är viskösa, med ett viskositetsvärde nära åttio gånger större än vatten och släpp mycket värme i början. Om du har kontakt med dem vänder de den hala huden på grund av förtvålningen av fettsyrorna i huden.
Basicitet (PKB)
- 0,56
pH
En 5 % P/P -lösning i vatten har ett pH nära 14
Brytningsindex (ND)
Vid en våglängd 580,4 nm: 1 433 till 320 ºC och 1 421 till 420 ° C.
Stabilitet
Behållarna som innehåller den måste vara tätt stängda för att förhindra bildning av natriumkarbonat. Detta beror på dess höga hygroskopicitet, vilket leder till att den absorberar fukten i dess miljö och dess samverkan2.
Sönderfall
När den värms upp till sönderdelning avger en rök från natriumoxid.
Självriktningspunkt
Det är inte brandfarligt
Gegga
4,0 CPOISE vid 350 ºC
Förångningsvärme
175 kJ/mol a 1.388 ºC
Ytspänning
74.35 Dynas/cm i en 2,72 % P/P -lösning i vatten vid 18 ° C.
Reaktivitet
Med syror
Reagerar med organiska och oorganiska mineralsyror, vilket orsakar vatten och motsvarande salt. När det gäller svavelsyra är reaktionen exoterm.
Kan tjäna dig: aluminiumsulfid (AL2S3): Struktur, egenskaper, användningar2 NaOH+H2Sw4 => Na2Sw4 + 2 h2ANTINGEN
Med sura oxider
Reagerar med svaveldioxid, till exempel ger ett salt sulfit och vatten:
2 NaOH +så2 => Na2Sw3 + H2ANTINGEN
Med metaller
Dess vattenhaltiga lösningar reagerar med vissa metaller för att orsaka komplexa natriumsalter. Till exempel ger hans reaktion med zink upphov till en natriumzinkato:
Zn + 2 NaOH + 2 H2O => na2[Zn (OH)4] + H2
Syntes
Natriumhydroxid syntetiseras huvudsakligen med två metoder: användning av natriumkarbonat, ursprungligen använd och natriumkloridelektrolys, för närvarande av större industriell användning.
Natriumkarbonatreaktion och kalciumhydroxid
Natriumkarbonat reagerar med kalciumhydroxid i en process som kallas Caustification:
Ca (oh)2 + Na2Co3 => Caco3 + Naoh
Kalciumkarbonat fälls ut och lämnar natriumhydroxid i supernatanten, som koncentreras av indunstning.
Natriumkarbonat kommer tidigare från solvay -processen:
2 NaCl+ Caco3 => Na2Co3 + CaCl2
Natriumkloridelektrolys
Natriumkloridelektrolys, närvarande i saltlösning, producerar vätgas, kloridgas och natriumhydroxid i vattenlösning:
2 NaCl+2 h2O => h2 + Kli2 + 2 NaOH
Den elektrolytiska kammaren består av ett fack där anoden (+), av titanmetall och plats där saltlösningen placeras. Detta fack är separerat från katodutrymmet (-) med ett poröst membran.
Följande reaktion inträffar vid anoden:
2 Cl- => Cl2 + 2 E- (Oxidation)
Samtidigt inträffar denna reaktion i katoden:
2 h2O +2 e- => H2 + Åh- (minskning)
Natrium (NA+) diffus från anodfacket till katoden, genom membranet som skiljer dem, bildar natriumhydroxid.
Ansökningar
Rengöringsprodukter
Natriumhydroxid används för tillverkning av tvålar och tvättmedel som används hemma och i kommersiell aktivitet. Kombinationen av natrium och klorhydroxid producerar klorblekmedel, används i vit klädtvätt.
Det eliminerar också ansamlingen av fett i avloppet och producerar dess eliminering genom dess omvandling till tvålar genom förtvålningsprocessen. Detta möjliggör eliminering av hinder för hushållsrör och andra byggnader.
Läkemedelsprodukter
Natriumhydroxid används i utarbetandet av vanliga smärtstillande medel, såsom aspirin. Också av läkemedel med antikoagulantverkan som blockerar bildningen av blodproppar och mediciner för att minska hyperkolesterolemi.
Energiprocesser
Natriumhydroxid används vid tillverkning av bränsleceller som fungerar som batterier för att producera elektricitet för olika applikationer, inklusive transport. Epoxihartser, tillverkade med natriumhydroxidintervention, används i vindkraftverk.
Det kan tjäna dig: galvanisk korrosion: mekanismer, exempel, skyddVattenbehandling
Natriumhydroxid används för att neutralisera vatten surhet och bidra till eliminering av tungmetaller i den. Det används också för natriumhypokloritproduktion, ett vattendesinfektionsmedel.
Natriumhydroxid reagerar med aluminiumsulfat för bildning av aluminiumhydroxid: flockningsmedel som används i vattenreningsverk för att öka partikelsedimentationen och producera dess förtydligande.
Papperstillverkning
Natriumhydroxid används med natriumsulfid vid behandling av trä för att erhålla cellulosa, på nästan rent sätt, som utgör basen på papperet. Det används också vid återvinning av papperet, eftersom det genom att hjälpa till att separera bläcket, tillåter oss att använda det igen.
Industriell tillverkning
Natriumhydroxid används vid tillverkning av rayón, spandex, sprängämnen, epoxihartser, glas och keramik. Det används i textilindustrin för färgämnen och bearbetar bomullstyg.
I sockerrörsbehandlingsanläggningar används natriumhydroxid med låg temperatur för sockerrör Bagazo -produktion.
Risker
Natriumhydroxid är en mycket frätande förening, så den kan orsaka, genom kontakt med huden, brännskadorna, ampuller och till och med permanenta ärr.
I kontakt med ögonen kan det ge allvarliga brännskador, svullnad, smärta, suddig syn och i allvarliga fall kan det orsaka permanent blindhet.
Natriumhydroxidintag kan orsaka brännskador på läpparna, tungan, halsen, matstrupen och magen. Bland de vanliga symtomen manifesteras manifesteras illamående, kräkningar, magkramper och diarré.
Även om inandning av natriumhydroxid är sällsynt och endast kan uppstå på grund av närvaron av sammansatt damm i luften eller genom bildandet av en dagg som innehåller den, ger den en irritation i lungorna.
När det gäller en kronisk exponering kan detta orsaka lungödem och svår andningskortning, vilket utgör en medicinsk nödsituation.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2019). Hydroxidnatrium. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). Hydroxidnatrium. Pubchemdatabas. CID = 14798. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Amerikanska element. (2019). Natriumhydroxidlösning. Hämtad från: Americanements.com
- Kemiska säkerhetsfakta. (2019). Hydroxidnatrium. Återställt från: ChemicalSafetyfacts.org
- NJ Health. (2015). Hydroxidnatrium. [Pdf]. Återhämtat sig från: nj.Gov
- Canadian Center for Occupational Health & Safety. (2019). Osh svarar faktablad: natriumhydroxid. Återhämtat sig från: cohs.Växelström
- Ausetute. (s.F.). Natriumhydroxid och klorproduktion genom elektrolys. Återhämtat sig från: ausetute.com.Au
- « Chol språk ursprung, egenskaper, var är du talat, ord
- Indexerade tidskrifter Egenskaper, kriterier, inflytelserika exempel »

