Jonisering i fysik och kemi koncept, process och exempel

- 1568
- 49
- Erik Eriksson
De jonisering Det är allt den processen där elektriska belastningar genereras från neutrala partiklar. Detta kan ske genom olika naturliga mekanismer eller krafter, antingen genom strålning, värme, elektriska fält, magnetfält eller kemiska reaktioner. Joner produceras som en konsekvens, som är positivt eller negativt laddade atomer.
Jonisering är en grundläggande process för symfiner för fysiska, kemiska eller naturliga fenomen, den senare är många gånger en blandning av fysikalisk -kemiska förändringar. I fysiska joniseringar förekommer till exempel inte kemiska reaktioner; Det vill säga att jonproduktion inte innebär nedbrytning eller bildning av nya länkar.
 Många naturfenomen, som norrsken, är baserade på joniseringen av atmosfärmolekyler. Källa: Pixabay.
Många naturfenomen, som norrsken, är baserade på joniseringen av atmosfärmolekyler. Källa: Pixabay. I naturfenomen åtföljs emellertid denna jonisering vanligtvis av kemiska reaktioner, såsom bildning av ozon i låga höjder. Under åskväder genereras kväveoxider på grund av strålarna och deras intensiva temperaturer, som oxiderar luftkvävet.
Å andra sidan kan joniseringen smyga upp: inom samma vatten, i gnidningen mellan två ytor, i oxidationerna av metallerna eller vid upplösning av vissa gaser i vatten.
[TOC]
Kemijonisering
Oxidation reduktion
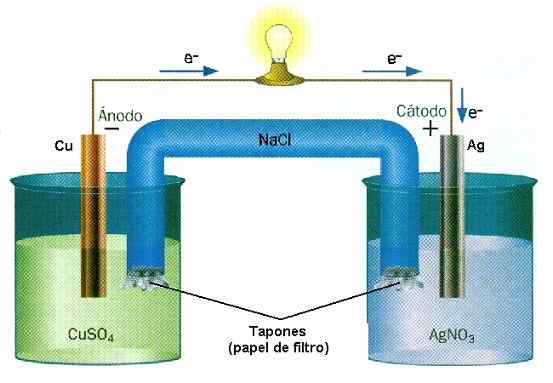 Under drift av batterierna på en leksak är joner och elektroner ständigt. Källa: D J Shin/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0)
Under drift av batterierna på en leksak är joner och elektroner ständigt. Källa: D J Shin/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0) Vid kemisk jonisering produceras joner genom att bryta eller länkbildning. Två ämnen tjänar eller förlorar elektroner irreversibelt: den som förlorar elektronerna får en positiv belastning, medan den som vinner behåller en negativ belastning.
 Exempel på minskning av oxidreaktion i Cu-AG-hög. Källa: Water Wall/CC BY-SA (http: // Creativecommons.Org/licenser/BY-SA/3.0/)
Exempel på minskning av oxidreaktion i Cu-AG-hög. Källa: Water Wall/CC BY-SA (http: // Creativecommons.Org/licenser/BY-SA/3.0/) I batterierna förlorar ett ämne elektroner medan en annan vinner dem. Dessa elektroner reser och aktiverar de elektriska kretsarna i en utrustning, för att äntligen återgå till ett andra högutrymme, där det andra ämnet väntar på dem för att fånga dem och ladda negativt. Detta är ett exempel på en kemisk jonisering som utförs genom en oxidreduktionsreaktion.
Kan tjäna dig: glukonsyra: struktur, egenskaper, syntes, användningHeterolytisk brott
En annan typ av kemisk jonisering beror på heterolitisk brott. När denna paus inträffar bryts A-B-länken för att bilda jonerna till+ och b-, Eftersom elektronerna riktas mot atomen som de "känner" större affinitet. Heterolitisk brott är vanligtvis det första steget som styr mekanismerna för många organiska reaktioner.
Selfionisering
Elektriska belastningar kan inte bara visas av elektronrörelsen i sig, utan av de länkar som är trasiga eller formar i ett utbyte av atomer. Detta är fallet med självorisering, som händer mellan två molekyler av samma förening.
Av alla kemiska joniseringar är självinisering den enklaste och mest omöjliga, eftersom den inte har förmågan att genomföra elektrisk ström av sig själv.
Jonisering i fysik
Statisk elektricitet
 Håret på den här flickan laddar positivt och avvisar varandra på grund av statisk elektricitet. Källa: Biseup Ganguly/CC av (https: // CreativeCommons.Org/licenser/av/3.0)
Håret på den här flickan laddar positivt och avvisar varandra på grund av statisk elektricitet. Källa: Biseup Ganguly/CC av (https: // CreativeCommons.Org/licenser/av/3.0) Jonisering har också mycket deltagande i fysiska fenomen. I allmänhet innebär fysikjonisering inte kemiska reaktioner. Materiets atomer laddas elektriskt utan att förlora sin ursprungliga identitet.
Ytor kan byta elektroner när de gnuggar om en av dem är effektivare för att förvara dem, vilket leder till statisk elektricitet. Det är inte längre samtal om atomer, utan om ett helt material som får en negativ eller positiv belastning, och att när balansen återställs kan en elektrisk chock bokstavligen generera mellan två material eller kroppar.
Gas-
Spridda gasformiga atomer kan förlora elektroner om de utsätts för ett elektriskt fält. På så sätt är atomer upphetsade och släppta elektroner. Sedan, när man kyler och återgår till sin status som en mindre energi, säger fotoner adjö. Och processen upprepas om och om igen. Resultatet: en källa till belysning eller el.
Kan tjäna dig: Bor Oxide (B2O3): Vad är, struktur, egenskaper, användningarStrålning eller kollisionsjonisering
På liknande sätt kan materia få energi som tillhandahålls av olika typer av strålning (gamma, x -rays, ultraviolett, etc.) eller genom att kollidera med partiklar med hög energi (ALFA, betas och neutroner).
Den bidragna energin är sådan att en elektron i atomen är omedelbar. Denna typ av jonisering är relaterad till flera radioaktiva och kosmiska fenomen.
Vattenjonisering
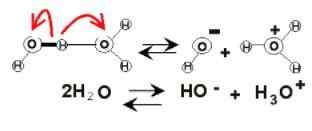 Vattendissociation
Vattendissociation I vattenskötet kan elektriska laddningar förekomma på grund av dess jonisering. Detta är av kemikalien, eftersom två vattenmolekyler plötsligt reagerar på varandra för att dissociera och generera hjonerna3ANTINGEN+ och åh-:
2h2Eller (l) ⇌ h3ANTINGEN+(AC) + OH-(Ac)
Denna balans har varit mycket förskjuten mot vattnet, så det finns knappast någon föraktlig mängd av dessa joner.
Luftjonisering
Luftmolekyler deltar inte i någon jämvikt av självinisering. Syre, kväve, argon, vattenånga och de andra gaserna som utgör luften, byter inte atomer eller elektroner. Därför är luft inte en bra elektricitetsledare under normala förhållanden.
Men om det utsätts för ett elektriskt fält, strålning eller intensiva temperaturer, kan det vara jon och bli en bra förare. Detta är vad som händer, till exempel när elektriska strålar faller från moln till jorden, resande elektroner genom luften med plötslig lätt explosion.
Joniseringsexempel
Under de tidigare avsnitten har några joniseringsexempel utsetts. Slutligen kommer vissa andra att nämnas.
Metalloxidation
När metaller oxiderar, antingen genom jordens syre eller genom attack av sura ämnen, förvärvar de positiva laddningar för att bilda oxider respektive salter.
Kan tjäna dig: kemisk process: principer, typer, exempelTill exempel joniseras järn tack vare syre för att förvandlas till tronjoner3+, Beläget i järnoxider kristaller. Magnesium upplöser å andra sidan svavelsyra för att förlora elektroner och stanna som Mg -joner2+ I magnesiumsulfat salt.
Gasupplösning i vatten
Vissa gaser, såsom ammoniak och väteklorid, löses upp i vatten för att förlora sin neutralitet och ge upphov till jonbildning. Till exempel släpper ammoniak när den löses delvis NH -joner4+ och åh-. Under tiden kommer väteklorid vid upplösning att producera hjoner3ANTINGEN+ och cl- fullständigt.
Ett liknande fall är upplösningen av salter i vatten, såsom magnesiumsulfat, mgso4. Men Mg -joner2+ Och så42- De är redan närvarande vid saltkristallerna innan de löses i vattnet.
Belysningslampor eller rör

I ånglampor eller belysningsrör är gasformiga atomer med elektriska stötar glada över att producera en viss mängd ljus och färger. Till exempel sker denna jonisering i natrium- eller kvicksilverlampor, liksom i de berömda neonljusen med sina ljusa färger i restaurang eller butiksposter.
Joniseringsenergier
Joniseringsenergi, en periodisk egenskap, studeras för att karakterisera kemiska element beroende på den lätthet som deras gasformiga atomer donerar sina elektroner för att positivt ladda. Således har till exempel metaller vanligtvis de lägsta joniseringsenergierna, medan icke -metalliska element och ädla gaser, de högsta.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Serway, R., Jewett, J. (2008). Fysik för vetenskap och teknik. Volym 1. 7th. Utgåva. Mexiko. Cengage Learning Editors.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2020). Jonisering. Hämtad från: i.Wikipedia.org
- Redaktörerna för Enyclopaedia Britannica. (17 oktober 2016). Jonisering. Encyclopædia Britannica. Återhämtat sig från: Britannica.com
- Doug Stewart. (2018). Definition av jonisering: Vad är jonisering? Återhämtat sig från: Chemicool.com
- John Zavisa. (1 april 2020). Hur blixt fungerar. Återhämtat sig från: vetenskap.HowStuffwork.com
- « 18 typer av beteende och deras egenskaper (med exempel)
- Gul liberalism Ursprung, egenskaper, orsaker, konsekvenser »

