Metaller
- 2608
- 254
- PhD. Emil Svensson
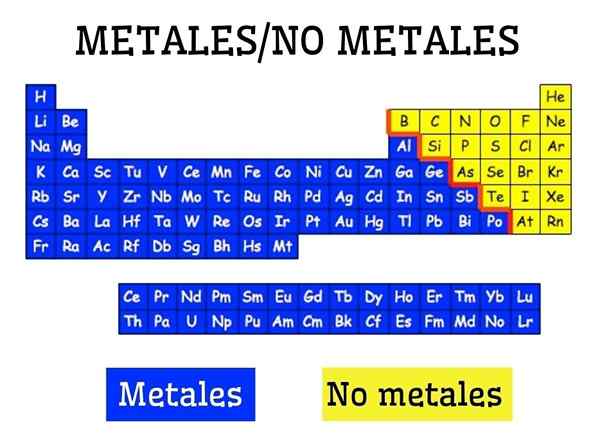
 Metaller och icke -metaller i den periodiska tabellen för elementen
Metaller och icke -metaller i den periodiska tabellen för elementen Vad är metaller?
Metaller bildas av en grupp element som finns på vänster sida, med undantag för det icke -metallväte, av det periodiska tabellen. Metaller utgör cirka 75 % av kemiska element, så det kan anges att mycket av naturen är metallisk.
Metallerna som människan ursprungligen åtalade i förhistorien var följande: guld, silver, koppar, tenn, bly och järn. Detta berodde på att de var infödda eller enkla bearbetning för att utföra verktygsobjekt.
Det verkar vara en fråga om magi att massor av stenar och mineraler kan extraheras glansiga och silverkroppar (med vissa viktiga och enastående undantag). Sådant är fallet med bauxit och aluminium, vars lera vaggar denna metall reduceras i plattor eller silverpapper erhålls.
Metaller är ramen för industrier; deras ledningar, reaktorer, enheter, behållare, allt på något eller annat sätt består av metaller och deras legeringar.
Med metaller gjordes de första mynten, vapen, verktyg, rustning och användes sedan i fordonstillverkningar, cyklar, fartyg, flygplan, datorer, bland andra oumbärliga föremål i det moderna livet.
Historia
Kopparålder
 Metallurgiutvidgning - Källa: Metallurgisk diffusion.SVG under Creative Commons attribut-CompaTyrigual 4 licens 4.0 internationell
Metallurgiutvidgning - Källa: Metallurgisk diffusion.SVG under Creative Commons attribut-CompaTyrigual 4 licens 4.0 internationell I 9000 a.C. De första metallobjekten av koppar smidd i Nära öst utarbetades, när mannen upptäckte att när koppar hamrade ökade han sin styrka och motstånd och använde den för tillverkning av knivar. Detta är kopparens ålder.
Det upptäcktes att koppar kunde erhållas genom uppvärmning av blå mineraler, såsom Corvellita och Malachite (4000-3000 till.C.).
Den kalkolitiska perioden är en tidsperiod som föregår bronsåldern, motsvarande 5000-3000 till.C. Mannen började experimentera med fusion och gjuteri av koppar, för att få koppar smidd från kopparoxid.
Bronsålder (3000-1500 a.C.)
 Bronze Age Materials - Källa: Gaguilella under Creative Commons -attributen -Säglig 4 Licens 4.0 internationell.
Bronze Age Materials - Källa: Gaguilella under Creative Commons -attributen -Säglig 4 Licens 4.0 internationell. Mannen började av misstag utarbetandet av legeringar, initialt av koppar och arsenik, och sedan med koppar och tenn för att få brons i Nära öst.
Bronsartiklar, motsvarande denna tid, hade 87 % koppar, 11 % tenn och små mängder järn, arsenik, nickel, bly och antimon.
Järnålder (700 a.C.)
Mannen använde sin erfarenhet av produktion av smidd koppar för produktion av smidesjärn i Nära öst. Under samma tidsperiod fanns granuleringen av Etruco -damm, Italien.
Den första kända stålproduktionen, en järn- och kollegering, manifesterade sig i metallstycken på en arkeologisk plats i Anatolia (1800 till.C.)
Kan tjäna dig: gravimetri: gravimetrisk analys, metoder, användningar och exempelMot 1122 d.C., På ett okänt datum och plats introduceras gjutjärn. 1440 d.C. Pekings stora klocka produceras, Kina. Nästan tre århundraden senare, 1709 d.C., Gjutjärn produceras med koks som brännbart material.
1779 användes gjutjärn i England som arkitektoniskt material. 1855 använde Henry Bessenir Arrabio som råmaterial för att få mjukt stål. Engelska Clark and Wood (1872) patent en legering, för närvarande betraktas som rostfritt stål.
Metallers fysiska egenskaper
 Bronen i dessa forntida klockor visar användbarheten av metaller för prydnads- eller religiösa ändamål. Källa: Pxhere.
Bronen i dessa forntida klockor visar användbarheten av metaller för prydnads- eller religiösa ändamål. Källa: Pxhere. Bland vissa fysiska egenskaper hos metaller har vi:
-Metaller är lysande och kan reflektera ljuset.
-I allmänhet är de goda ledare av el och värme.
-De har höga fusions- och kokpunkter.
-De är formbara, det vill säga de kan hamras för att producera låga tjocka ark.

-De är duktila, med dem kan du tillverka ledningar eller fibrer med mycket liten diameter.
-De presenteras i ett fast tillstånd, med undantag av kvicksilver att vid rumstemperaturen är i flytande tillstånd, och gallium, som smälter bara genom att dra åt i händerna i händerna. I följande bild kan du se en kvicksilverbehållare:

-De är ogenomskinliga kroppar, deras tunna lakan korsas inte av ljuset.
-De har stor hårdhet, med undantag för natrium och kalium som kan skäras av en kniv.
-De har en hög densitet, är osmium och iridium av det högsta, och litium av den lägsta densiteten.
Kemiska egenskaper hos metaller
Bland några av de kemiska egenskaperna hos metaller har vi:
-De tenderar att förlora elektroner och bilda metallkatjoner, mn+, Där N indikerar sitt oxidationsnummer, som endast för alkaliska och alkalistiska metaller sammanfaller med sitt valensnummer.
-Dess elektronegativitet är låga.
-De kör och upplever oxidationsskador.
-De bildar grundläggande oxider när de reagerar med syre. Dessa oxider i kombination med vatten bildar metallhydroxider. Metalloxider reagerar med syror för att bilda salter och vatten.
-De är bra reducerande agenter, eftersom de ger sina elektroner.
Typer av metaller
Metaller klassificeras som följande: alkaliskt, alkaliskt försök, postövergång, övergångs- och så kallade sällsynta jordar.
Alkaliska metaller

De befinner sig vanligtvis inte fria i naturen eftersom de lätt oxiderar. Har en suborbital1 I sitt yttre omloppsskikt, så de har ett oxidationstillstånd +1. De är metaller som reagerar exotermiskt med vatten och minskar starkt.
Alkaliskt-térreosmetaller
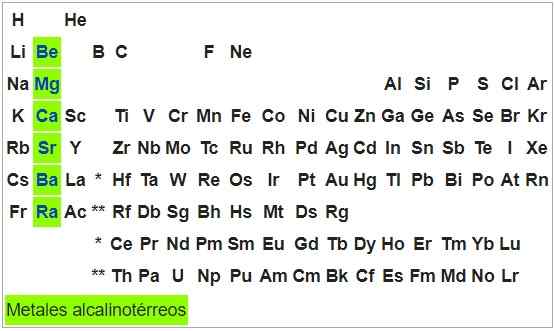
De är formbara och duktila metaller. Atomerna i elementen i denna grupp har en S -konfiguration2, Så de kan ge två elektroner och deras oxidationsstatus är +2. Med undantag av beryllium är de oxiderbara för luftexponering.
Kan tjäna dig: kolalotroperPosttransitionsmetaller
De är metaller i det så kallade P -blocket, beläget mellan övergångsmetaller och metalloider i det periodiska tabellen.
Elementen i grupp 3 har oxidationstillstånd +1 och +3 som de vanligaste, även om aluminium endast presenterar oxidationstillståndet +3. Det är också en del av eftertransitionsmetallerna i grupperna 14 och 15.
Övergångsmetaller D
De bildar en grupp mellan basformande element och syraformatorer. Atomiska orbitaler D och F är ofullständiga och fylls. Även om termen övergångsmetaller hänvisar till övergångsmetaller d.
Övergångsmetaller har mer än ett oxidationstillstånd. De har fusions- och kokpunkter högre än andra metallgrupper. Övergångsmetaller är en mycket heterogen metallgrupp som bland annat inkluderar järn, krom, silver, etc.
Sällsynt jord
 Mineraliska mineral
Mineraliska mineral Denna grupp av metaller består av Elements Scandio och Ititrio och elementen i serien av Lantanides och Actinids. Termen "sällsynt jord" hänvisar till det faktum att de inte finns i naturen i rena tillstånd och kan fästas av syror.
Användning/applikationer av metaller
Alkaliska metaller
Litium används som värmeöverföring betyder i vissa kärnreaktorer. Det används i vissa torra batterier och ackumulatorer med liten vikt. Klorid och litiumbromid är hygroskopiska föreningar som används i industriella torknings- och luftkonditioneringsprocesser.
Natrium används i metallmetallurgi, såsom titan och zirkonium. Det används i offentlig belysning i natriumbåglampor. Natriumklorid (NaCl) används som en matsmak och köttbevarande.
Alkalinetermetaller
Magnesium användes i fotografering som blixtljus och fyrverkerier. Barium är en del av legeringar som används i tändstift på grund av elementets enkelhet för att avge elektroner. Bariumsalter används för att begränsa skadorna som orsakas av x -strålar i gastrointestinala traktplattor.
Kalcium används för att eliminera föroreningar som är upplösta i smälta metaller och vid eliminering av restgaser i vakuumrör. Det är en del av gipsen, material som används vid konstruktion och vid behandling av benfrakturer.
Posttransitionsmetaller
Aluminium eftersom det är en lätt metall används vid konstruktion av flygplan och fartyg. Det används också i utarbetandet av många köksredskap. Det används som råmaterial vid tillverkning av deodoranter som begränsar svettning.
Kan tjäna dig: procentuella lösningarGallium används i transistorer och termometrar för höga temperaturer. Isotopen 67GA används i medicin vid behandling av vissa melanom. Bly används vid konstruktion av batterier och i skydd mot joniserande strålning.
Övergångsmetaller
Koppar används i vattenförsörjningsrör, i kylskåp och luftkonditioneringssystem. Det används också som en del av datorns värmespridningsmekanism. Det används i ledningen av elektrisk ström, i elektromagneter och i färgfärgningen.
Nickeln används i utarbetandet av rostfritt stål, såväl som gitarrsträngar och laddningsbara batterier. Det används också i galvanoplastik i metallskydd. Det används i legeringar som finns i delar av fordon, såsom ventiler, lager och bromsar.
Nickelen har använts under lång tid i utarbetandet av mynt.
Zink används i korrosionsmetallskydd, i mässingsproduktion. Zinkoxid och zinksulfat används vid tillverkning av plattor som används i tak, rännor och downspouts.
Krom används vid metallkorrosionsskydd och leveranser lyser. Det används som en katalysator i ammoniaksyntesreaktionen (NH3). Kromoxid används i träskydd.
Sällsynt jord
Skandio används i aluminium aluminium för flyg- och rymdkomponenter. Det är ett tillsatsmedel i kvicksilverånga lampor.
Lantano används i hög brytning och alkalisresistent glas. Dessutom används det vid tillverkning av kameralinser och som katalytiska katalysatorvätskor för oljeraffinaderier.
Cerio används som kemiskt medel. Dessutom används det för tillförsel av ett gult glas och keramisk färg, såväl som katalysator för självarbetande ugnar.
Exempel på metallelement
Alkalisk
Natrium (NA), kalium (K), cesio (CS), litium (LI) och rubidium (RU).
Alkaliskt terreos
Beryllium (BE), magnesium (mg), kalcium (CA), strontium (MR), barium (BA) och radio (RA).
Posttransitions-
Aluminium (AL), gallium (GA), Indian (in), Talio (TL), Tin (SN) och bly (PB).
Övergångs-
Titan (Ti), vanadium (V), krom (Cr), mangan (Mn), järn (tro), kobolt (CO), nickel (Ni), koppar (Cuinc), zink (Zn), zirkonium (Zr), Niobio (NB), Molybden (MO), Paladio (PD), Silver (AG), Volframium (W), Renio (Re), Osmio (OS), Iridido (IR),
Platinum (PT), guld (AU) och kvicksilver (HG).
Sällsynt jord
Scandio (SC), Itrio (Y), Lantano (LA), Cerio (CE), Praseodimio (PR), Neodymium (ND), Samarium (SM), Europio (EU), Gadolinio (GD), Holmio (HO), Erbio (ER), Tulio (TM), Iterbio (YB) och Luthacio (LU).
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Helmestine, Anne Marie, PH.D. (5 oktober 2019). Metaller kontra icke -metaller. Återhämtat sig från: tankco.com
- Metaller och deras egenskaper-fysiska och kemiska. [Pdf]. Återhämtat sig från: csun.Edu
- Jonathanmästare. (2019). 18 olika typer av metall (fakta och användningar). Återhämtat sig från: makeitfrometal.com

