Degenererade orbitaler

- 3541
- 498
- Hans Olsson
 Energisystem med orbitalerna ockuperade av saknade elektroner. Källa: Gabriel Bolívar
Energisystem med orbitalerna ockuperade av saknade elektroner. Källa: Gabriel Bolívar De Degenererade orbitaler De är de som finns på samma energinivå. Enligt denna definition måste de ha samma huvudantal n. Således degenereras 2S- och 2P -orbitaler, eftersom de tillhör energinivå 2, även om det är känt att deras funktioner av vinkel- och radiella vågor är olika.
Som värdena på n, Elektroner börjar ockupera andra energiunderlag, såsom D- och F -orbitaler.
Var och en av dessa orbitaler har sina egna egenskaper, som vid första anblicken observeras i deras vinkelformer; Dessa är de sfäriska figurerna, av hantlar (P), av klöverblad (D) och kula (F).
Bland dem finns det en energiskillnad, till och med tillhör samma nivå n.
Till exempel visas ett energisystem med de orbitaler som är ockuperade av saknade elektroner (ett onormalt fall) i den övre bilden (ett onormalt fall).
Det kan ses att av alla, den mest stabila (den minsta energin) är NS -omloppet (1s, 2s, ...), medan NF är den mest instabila (den med den största energin).
Degenererade orbitaler av en isolerad atom
Degenererade orbitaler, med samma värde som n, De är i samma linje i ett energisystem.
Av denna anledning är de tre röda ränderna som symboliserar orbitalerna P i samma linje; Som på samma sätt gör de lila och gula ränderna.
Bildschemat bryter mot diskbänksregeln: orbitalerna för större energi är fyllda med elektroner.
Kan tjäna dig: syror och baser: skillnader, egenskaper, exempelNär elektronerna parar, förlorar omloppet energi och utövar en större elektrostatisk avstötning på de andra orbitalernas saknade elektroner.
Sådana effekter beaktas emellertid inte i många energidiagram. Om så är fallet, och följer diskbänksregeln utan att helt fylla orbitalerna d, skulle man se att de upphör att vara degenererade.
Som nämnts ovan har varje orbital sina egna egenskaper. En isolerad atom, med sin elektroniska konfiguration, är villig sina elektroner i det exakta antalet orbitaler som gör att de kan vara värd för dem.
Endast de i energi kan betraktas som degenererade.
Orbitaler p
De tre röda ränderna för bildens orbitaler indikerar att båda px, poch Och sz De har samma energi.
Det finns en elektron som försvinner i var och en, beskrivet av fyra kvantantal (n, l, ml och Fröken), medan de tre första beskriver orbitalerna.
Den enda skillnaden mellan dem betecknas av det magnetiska ögonblicket ml, som drar banan på Px På en x -axel, soch på y -axeln och Pz på z -axeln.
De tre är desamma, men de skiljer sig bara i sina rumsliga inriktningar. Av denna anledning dras de alltid i energi, det vill säga degenerera.
Liksom är densamma, en inomotiv kväveatom (med 1S -konfiguration22s22 p3) Du måste hålla dina tre orbitaler degenererade. Emellertid förändras energiscenariot plötsligt om det betraktas som en atom av N inom en kemisk molekyl eller förening.
Det är så för att även om Px, poch Och sz De är desamma i energi, detta kan variera i var och en av dem om de har olika kemiska miljöer; det vill säga om de är kopplade till olika atomer.
Kan tjäna dig: Isopreno: Struktur, egenskaper, applikationerOrbital d
De fem lila ränderna anger orbitalerna d. I en isolerad atom, även om de har parat elektroner, anses de att dessa fem orbitaler är degenererade. Till skillnad från P -orbitalerna finns det dock en markant skillnad i deras vinkelformer.
Därför reser deras elektroner vägbeskrivningar i rymden som varierar från en orbital d till en annan.
Detta orsakar enligt Kristallin fältteori, att en minimal störning orsakar a Energiutveckling av orbitalerna; Det vill säga, de fem lila ränderna separerar och lämnar ett energigap mellan dem:
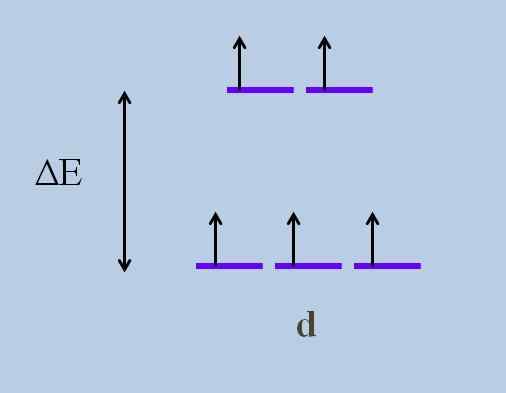 Energiutvecklingsschema för orbitaler. Källa: Gabriel Bolívar
Energiutvecklingsschema för orbitaler. Källa: Gabriel Bolívar Vilka är orbitalerna ovan och vilka är de nedan? De ovanför symboliseras som ochg, och de nedan t2 g.
Observera hur initialt alla lila ränder var inriktade, och nu bildades en uppsättning av två orbitaler ochg mer energi än den andra uppsättningen av tre orbitaler t2 g.
Denna teori gör det möjligt att förklara D-D-övergångarna, till vilka många av de färger som observerats i föreningarna i övergångsmetallerna (Cr, Mn, Tro, etc. tilldelas.).
Denna elektroniska störning beror på samordningsinteraktioner mellan metallcentret med andra molekyler som kallas Ligander.
Orbitaler f
Och med orbitalerna f, de sju gula ränderna, är situationen ytterligare komplicerad. Dess rumsliga adresser varierar mycket mellan dem, och visualiseringen av deras länkar blir för komplex.
I själva verket anses det att orbitaler f är av ett sådant inre skikt att de inte "deltar märkbart" i bildandet av länkar.
Det kan tjäna dig: Perklorisk oxid (CL2O7)När atomen som isoleras med orbitaler F är omgiven av andra atomer, börjar interaktioner och utvecklas (förlust av degeneration):
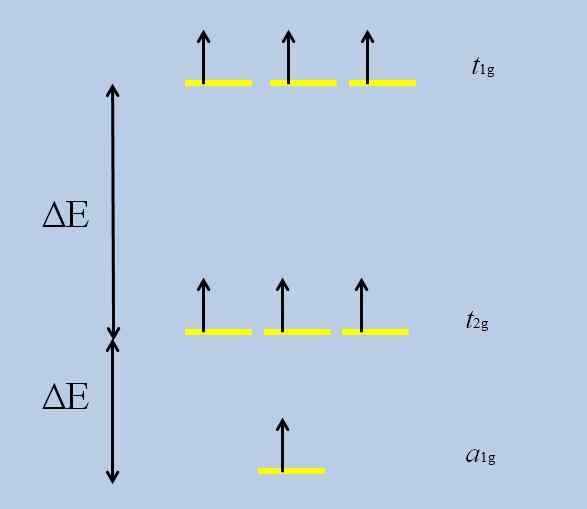 Degenerationsförlust. Källa: Gabriel Bolívar
Degenerationsförlust. Källa: Gabriel Bolívar Observera att nu de gula ränderna bildar tre uppsättningar: t1g, t2 g och till1g, Och de är inte längre degenererade.
Degenererade hybridbanor
Det har sett att orbitaler kan utvecklas och förlora degeneration. Även om detta förklarar elektroniska övergångar klargör det inte hur och varför det finns olika molekylgeometrier. Här kommer hybrid orbitaler in.
Dess huvudsakliga egenskap är att de är degenererade. Således uppstår de från blandningen av orbitalkaraktärer S, P, D och F, för att orsaka degenererade hybrider.
Till exempel blandas tre P -orbitaler med en S för att ge fyra SP -orbitaler3. Alla sp orbitaler3 De är degenererade och har därför samma energi.
Om dessutom två orbitaler blandas med de fyra sp3, Sex orbitaler kommer att erhållas3d2.
Och hur förklarar molekylära geometrier? Eftersom det finns sex, med lika energier, måste de följaktligen styras symmetriskt i utrymmet för att generera lika kemiska miljöer (till exempel i en MF -förening6).
När de gör det bildas en oktaedron för koordination, vilket är lika med en oktaedral geometri runt ett centrum (m).
Men geometrier presenterar vanligtvis snedvridningar, vilket innebär att även hybrid orbitaler inte är helt degenererade.
Därför existerar degenererade orbitaler endast i isolerade atomer eller mycket symmetriska miljöer.
Referenser
- Definition av degerate. Återhämtat sig från: Chemicool.com
- Atomer och atomorbitaler. Återhämtat sig från gnistrande.com
- Whitten, Davis, Peck & Stanley. Kemi. (8.ª ed.). Cengage Learning.

