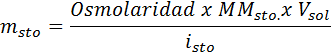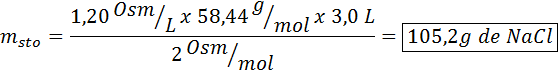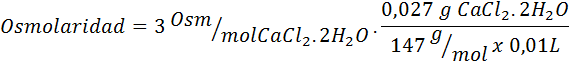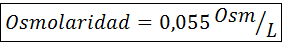Osmolaritet
- 1880
- 164
- Per Karlsson
Vad är osmolaritet?
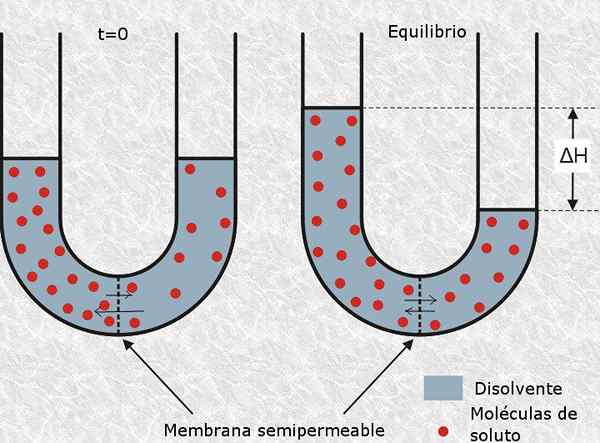
De Osmolaritet Det är en koncentrationsenhet som indikerar den molära koncentrationen av uppsättningen osmotiskt aktiva partiklar som finns i en lösning. Med andra ord, osmolaritet är molariteten hos osmotiskt aktiva partiklar.
är definierad som osmotiskt aktiv partikel till den neutrala eller jonmolekylen som inte kan korsa ett semipermeabelt membran, såsom cellmembranet. Närvaron av denna typ av partiklar genererar osmotiskt tryck i lösningen, och därmed namnet.
Antalet mol osmotiskt aktiva partiklar kallas Osmol (representerad av OSM -symbolen), så osmolaritet uttrycks i enheter av Osm/l.
Vikten av osmolaritet
Osmolaritet är ett begrepp av stor betydelse för biologi och medicin, eftersom den osmotiska balansen mellan celler med deras miljö är avgörande för deras överlevnad. Till exempel att injicera en lösning med en mycket hög eller mycket låg osmolaritet intravenöst kan lätt orsaka dödsfall för en patient.
 Osmolaritet är en väsentlig aspekt av lösningar inom medicin och biologi
Osmolaritet är en väsentlig aspekt av lösningar inom medicin och biologi Å andra sidan är en mycket vanlig teknik som cellbiologer använder för att bryta celler av olika typer genom osmotisk lys. Detta består av att placera cellerna i en hypotonisk lösning (med en mycket låg osmolaritet) så att lösningens vatten penetrerar dem genom osmos och brister dem.
Detta gör det mycket viktigt, både för läkare och för biologer och proffs från andra områden, att veta, mäta eller veta hur man beräknar osmolariteten hos en lösning.
Kan tjäna dig: procentuell koncentrationSkillnader mellan osmolaritet och osmolalitet
När man pratar om osmolaritet är det också nödvändigt att prata om osmolalitet. Osmolalitet liknar osmolaritet, på samma sätt som moral liknar molaritet.
Medan osmolaritet indikerar Antal osmol per liter lösning (OSM/L), Osmolalitet indikerar detsamma, men För varje kilogram lösningsmedel (OSM/kg).
Osmolalitet har fördelen att inte beroende på lösningsvolymen och inte heller beror på densiteten eller temperaturen. Av denna anledning kommer en lösning att ha samma osmolalitet vid 25 ° C som vid 37 ° C. Å andra sidan kommer dess 37 ° C osmolaritet att vara något lägre än dess osmolaritet vid 25 ° C, på grund av ökningen av värmeutvidgningsvolymen.
Osmolaralitet är vanligtvis lättare att mäta experimentellt än osmolaritet. Osmolaritet är emellertid lättare att beräkna och är en enklare enhet att arbeta när utspädningar förbereds.
Hur beräknas osmolariteten hos en lösning?
Det finns flera sätt att beräkna osmolariteten hos en lösning, beroende på informationen som räknas. Det kan beräknas från:
- Mängden lösta ämnen och lösning.
- Molariteten hos de närvarande lösta ämnena.
- Individuella jonkoncentrationer.
- Procentandelen m/v för lösta ämnen, bland andra.
I alla fall är beräkningen baserad på den allmänna formeln för osmolaritet, vilket är:

Var nOsm Det är antalet osmoler som finns i lösningen och VSol Det är volymen på samma uttryckt i liter. Antalet osmol beräknas genom att multiplicera antalet mol i det lösta ämnet med antalet partiklar där det dissocierar i lösning.
Kan tjäna dig: heterogena blandningar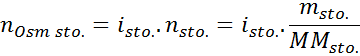
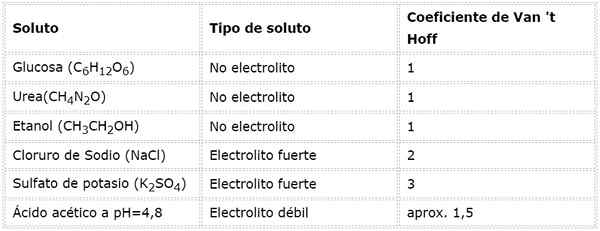
I denna ekvation, nsto Det är antalet mol löst, msto är dess massa (i g), Mmsto Det är dess molmassa (i g/mol) och Yosto Det är koefficienten för Van 't hoff för lösta ämnet. Denna koefficient har ett värde av 1 för icke -elektrolyter lösta ämnen (Som glukos, till exempel).
För starka elektrolyter som är fullständigt dissocierade (såsom natriumklorid, NaCl) är skåpbilskoefficienten lika med det totala antalet joner i vilka varje mol av föreningen dissocierar.
Till exempel när det gäller kaliumsulfat, K2Sw4, vars dissocieringsreaktion är:
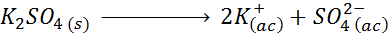
Varje mol av saltet som upplöses producerar 3 mol joner (2 kjoner+ Och 1 så jon42-), därav I = n = 3.
När det gäller svaga elektrolyter är beräkningen mer komplicerad, men de är vanligtvis bestämda experimentellt. Följande tabell sammanfattar koefficienterna för Van 't hoff för några vanliga lösta ämnen.
Exempel på osmolaritetsberäkning
1. Exempel 1
Bestäm osmolariteten för en beredd lösning genom att lösa 10 g NaCl och 10 g glukos i 100 ml lösning
Lösning: I detta fall beräknas osmolerna för varje lösta ämnen separat och tillsätt sedan. Molmassorna är 58,45 g/mol respektive 180 g/mol, och de ve 't hoff -koefficienterna är 2 och 1:
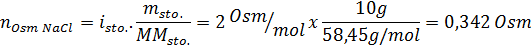
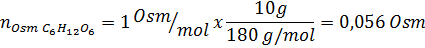
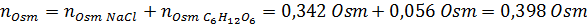
Nu beräknar vi osmolariteten med hjälp av formeln och vet att 100 ml är lika med 0,100L:
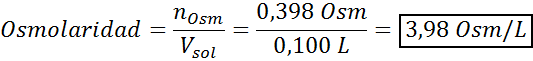
Slutligen är lösningens osmolaritet 3,98 osm/l.
2. Exempel 2
Bestäm osmolariteten för en 0,05 lösning kaliumsulfatmolar.
Lösning: Om vi redan känner till molariteten för det lösta ämnet är det lika enkelt att beräkna osmolariteten som att multiplicera denna koncentration med skåpbilen.
Kan tjäna dig: bensaldehyd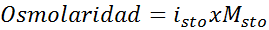
I detta fall är saltfaktorn 3.
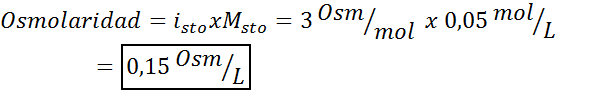
3. Exempel 3
Bestäm osmolariteten hos ett plasmaprov som innehåller 0,125 M natriumjoner, 0,020 M kaliumjoner och 0,145 kloridjoner.
Lösning: Osmolariteten hos de enskilda jonerna är lika med deras molaritet, eftersom jonerna inte dissocierar mer och har en I = 1. Av detta skäl är det i detta fall bara nödvändigt att multiplicera med I = 1 Varje koncentration och lägg till:
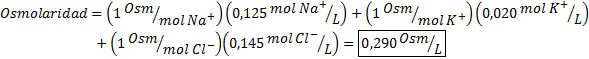
4. Exempel 4
Beräkna osmolariteten hos en lösning som innehåller 27 mg lock2.2h2Eller för varje 10 ml lösning
Lösning: COCHL -molekylvikten2.2h2Eller det är 147 g/mol. Vid upplösning separeras detta salt i 2 vattenmolekyler och tre joner. Vattenmolekyler är emellertid inte osmotiskt aktiva partiklar så att de inte beaktas för beräkningen av osmolaritet, och koefficienten för denna förening är 3.

5. Exempel 5
Vilken massa natriumklorid behövs för att framställa 3 liter av en lösning vars osmolaritet är 1,20 osm/l?
Lösning: I det här fallet, eftersom massan av lösta ämnen begärs och vi har volym och koncentration räcker det för att rensa massan av osmolaritetsformeln.