Ekvivalent
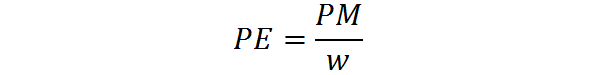
- 1926
- 310
- Per Eriksson
Vad är motsvarande vikt?
han ekvivalent Det är vikten eller massan av en motsvarighet av substans. Det vill säga, det är vikten eller massan av ett ämne som kemiskt är lika med en mol av ett annat ämne av samma typ som används som referensmönster och anses vara normalt.
Det normala ämnet som tagits som referens beror på vilken typ av kemisk reaktion involverad och den roll som föreningen spelar i den reaktionen. Normala föreningar reagerar alltid med varandra med stökiometri 1: 1.
Om vi till exempel pratar om en syra/basreaktion skulle den ekvivalenta vikten av en syra vara vikten av nämnda förening som motsvarar 1 mol av en normal syra, som är en som har en enda joniserbar proton.
Innan det var känt att saken bildades av atomer och molekyler hade en serie lagar som bestämde massförhållandet (eller vikten) mellan reagens och produkter från en kemisk reaktion redan fastställts.
Dessa lagar bildade grunden för stökiometriska beräkningar under början av kemi som vetenskap.
Motsvarande viktkoncept är relaterat till detta tidiga stadium av kemiutveckling. Därefter diskuterar vi hur det beräknas, vad det är för och några vanliga exempel på din beräkning.
Formel och motsvarande viktenheter
Den motsvarande vikten beräknas utifrån molekylvikten för ett ämne med hjälp av följande formel:
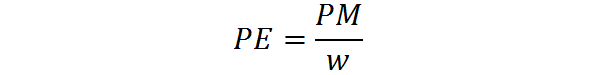
Där PE är motsvarande vikt, är PM molekylvikten eller molmassan på ämnet, och W representerar antalet ekvivalenter per mol.
Det senare består alltid av ett heltal lika eller större än 1. Det representerar antalet molekyler av ett "normalt" reagens till vilket varje substansmolekyl är ekvivalent. Därför beror det på vilken typ av reagens i fråga och typen av kemisk reaktion involverad.
Kan tjäna dig: dihydroxyaceton: struktur, egenskaper, erhållning, användningarDet kan också beräknas från degen, M och antalet motsvarande:
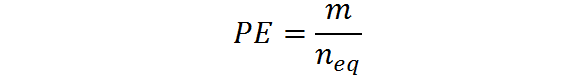
Motsvarande viktenheter
Som framgår av den tidigare formeln uttrycks motsvarande vikt i massenheter (vanligtvis gram) på antalet motsvarande motsvarande. Det vill säga enheterna är g/ekv.
Värdet av W I den första föregående formeln uttrycks den i motsvarande enheter på mol (ekv/mol), medan molmassan uttrycks i gram över mol (g/mol).
Vad är motsvarande vikt för?
Den huvudsakliga användbarheten av motsvarande vikt är att den förenklar de stökiometriska beräkningarna. Den motsvarande vikten av ett ämne motsvarar ett annat ämne av samma typ och för samma typ av kemisk reaktion. Därifrån får han faktiskt sitt namn.
Detta gör att vi kan utföra stökiometriska beräkningar på ett mycket enkelt sätt och utan att behöva skriva och balansera kemiska ekvationer.
Hur beräknas motsvarande vikt?
Som vi såg tidigare beräknas motsvarande vikt utifrån molekylvikten och antalet ekvivalenter per mol eller w.
Beräkning av molekylvikt
Molekylvikten hos ett ämne bestäms genom att tillsätta atomvikten för alla atomer som utgör den. Dessa atomvikter finns i den periodiska tabellen.
Fastställande av W
Värdet av W För ett ämne beror det på vilken typ av reaktion som den är involverad. Det vill säga det beror på vilken typ av reagens i fråga. För varje typ av ämne finns det ett annat sätt att bestämma W.
Följande tabell visar hur det bestäms W För olika fall.
Det kan tjäna dig: kalciumhypoklorit (CA (CLO) 2)| Reagens typ | Värdet av W |
| Syror | Antal joniserbara hydrogener för varje syramolekyl. |
| Baser | Antal protoner som kan fånga eller neutralisera varje basmolekyl. |
| Oxiderande medel | Antal elektroner som fångar varje mol av oxidationsmedel i semi -omarbetningen av reduktion. |
| Reducerande agenter | Antal elektroner som släpps ut varje mol reducerande medel i oxidationssalvagning. |
| Du går ut | Totalt antal positiva eller negativa laddningar som genereras när ett av saltet. |
| Neutrala ämnen | 1 |
Det bör noteras att om ett ämne kan delta i mer än en typ av kemisk reaktion kan det ha mer än ett värde på W Och därför mer än en motsvarande vikt.
Betydelse och tillämpningar av motsvarande vikt
Ekvivalentvikten används för att beräkna antalet ekvivalenter för en kemikalie. Detta antal ekvivalenter är alltid lika med antalet ekvivalenter av ett annat ämne som det reagerar.
Detta används främst i två olika områden:
I analytisk kemi
Ekvivalenterna används ofta för att underlätta stökiometriska beräkningar i analytisk kemi. Detta gäller särskilt när det gäller volym och gravimetrisk analys.
Kunskapen om graden av graden vid ekvivalenspunkt och koncentrationen av titeln, såväl som motsvarande vikt för den berättigade, tillåt lätt att beräkna massan för analyt som finns i ett prov.
I elektrolys
Inom elektrolysfältet representerar motsvarande vikt vikten av en metall eller annan substans som kan uppstå när 96.500 C Laddning genom elektrolytisk cell. Detta underlättar stökiometriska och ekonomiska beräkningar av elektrolysprocessen.
Kan tjäna dig: Mercury Oxide (HG2O)Exempel på motsvarande viktberäkning
Kalcium
Atomvikten för kalcium är 40 och denna metall bildar katjoner med Valencia +2, så dess motsvarande vikt är 40/2 = 20 g/ekv.
Svavelsyra (h2Sw4)
Molekylvikten för denna förening är 98 och är en diplinsyra, så W = 2. Därför är motsvarande vikt PE: 98/2 = 49 g/ekv.
Aluminiumhydroxid (AL (OH)3)
Aluminiumhydroxid (PM = 78) är en amphoterförening som kan fungera som syra och som bas.
Om du agerar som bas genom att släppa dina tre hydroxider, då W = 3, Så PE: 78/3 = 26 g/ekv. Å andra sidan, när den fungerar som en syra, fångar den en vattenmolekyl och släpper en proton, så i det här fallet, W = 1 och PE = 78 g/ekv.
Kalciumfosfat (CA3(PO4)2)
Kalciumfosfat är ett salt som, när de dissocierar, producerar 3 Ca -joner2+ och 2 joner po43-.
I alla fall är antalet belastningar av samma tecken som varje kalciumfosfatenhet producerar 6, så W = 6 och PE = 310/6 = 51,67 g/ekv.
Referenser
- Universal Encyclopedia (s. F.). Ekvivalent. Taget från encyklopedia_universal.Es-akademisk.com.
- Kemi, oorganisk kemi (s. F.). Ekvivalent. Hämtad från Fullquimica.com.
- Kemi.Det är s. F.). Likvärdig. Hämtad från kemi.är.
- Spiegato (2021). Vad är motsvarande vikt? Hämtad från Spiegato.com.

