Pyruvatkinasstruktur, funktion, reglering, hämning
- 608
- 162
- Anders Svensson
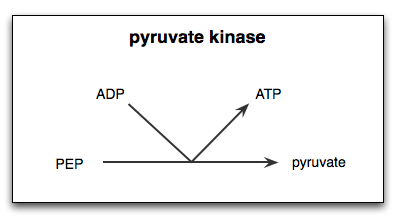
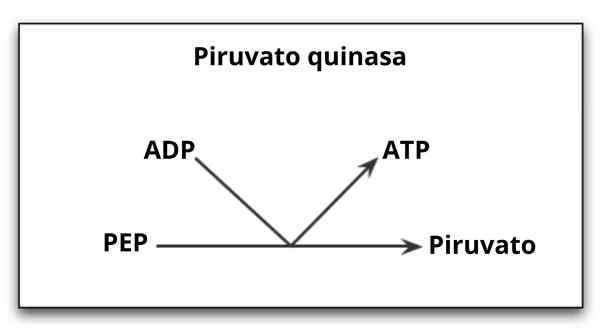 Reaktionskatalyserad av enzymet pyruvato -kinas
Reaktionskatalyserad av enzymet pyruvato -kinas Vad är kinaspyruvaten?
De Pyruvatkinas (Pek) Det är enzymet som katalyserar det sista steget i den glykolytiska vägen, vilket innebär en irreversibel överföring av fosfatgruppen av en fosfoenolpiruvat (PEP) molekyl mot en ADP -molekyl, vilket resulterar i syntesen av en ATP -molekyl och en annan av pyruvinsyran eller pyruvat.
The pyruvate thus produced later participates in various catabolic and anabolic (biosynthetic) routes: it can be decarboxylated to produce acetyl-coa, carboxylated to produce oxalacetate, transaminated to produce alanine, oxidized to produce lactic acid or can be directed towards gluconeogenesis for synthesis of glukos.
Eftersom det deltar i glykolys är detta enzym av största vikt för kolhydratmetabolism hos många organismer, encellulär och multicellulär, som använder detta som den huvudsakliga kataboliska vägen för att få energi.
Ett exempel på strikt beroende celler av glykolys för att erhålla energi är den av däggdjurs erytrocyter, för vilka en brist i någon av de enzymer som deltar i denna rutt kan ha betydligt negativa effekter.
Pyruvatkinasstruktur
Hos däggdjur har fyra isoformer av enzympyruvatkinas beskrivits:
- Pkm1, Typiskt i muskler
- Pkm2, Endast i foster (båda produkterna från alternativ bearbetning av samma messenger RNA)
- Pkl, närvarande i levern och
- Pkr, närvarande i erytrocyter (båda kodade av samma gen, Pklr, men transkriberas av olika promotorer).
Analysen som genomförts till strukturen hos de olika enzymerna pyruvatkinas i naturen (inklusive dessa 4 av däggdjur) visar en stor likhet i den allmänna strukturen, liksom med avseende på arkitekturen för den aktiva platsen och regleringsmekanismerna.
Kan tjäna dig: Kolonialföreningar: Egenskaper, typer och exempelI allmänhet är det ett enzym med 200 kDa molekylvikt, kännetecknad av en tetramerisk struktur sammansatt av 4 identiska proteinenheter, mer eller mindre 50 eller 60 kDa, och var och en med fyra domäner, nämligen:
- En domän spiralformad Liten vid den N-terminala änden (frånvarande i bakterieenzymer)
- En domän "TILL”, Identifierad av en topologi med 8 vikta ß -skivor och 8 hallar α
- En domän "B”, Infogad mellan den vikta beta -lamina nummer 3 och alfa -domänen” A ”-domändomänen
- En domän "C”, Som har en α+ß -topologi
 Molekylär struktur av enzympyruvatkinas
Molekylär struktur av enzympyruvatkinas Tre platser har detekterats i tetramrarna i kinaspyruvatet av olika organismer: det aktiva stället, effektorplatsen och aminosyrebindningsstället. Den aktiva platsen för dessa enzymer är mellan domäner A och B, nära ”effektorplatsen”, som tillhör domän C.
I Tetrámero bildar D -domäner ett "litet" gränssnitt, medan domäner i form av ett större gränssnitt.
Funktion av kinaspyruvat
Som redan nämnts katalyserar kinaspyruvatet det sista steget i den glykolytiska vägen, det vill säga överföring av en fosfatgrupp från fosfoenolpiruvat (PEP) till en ADP -molekyl för att producera en ATP och en pyruvat eller pyruvinsyramolekyl.
Produkterna från reaktionen katalyserad av detta enzym är av största vikt för olika metaboliska sammanhang. Pyruvate kan användas på olika sätt:
- Under aeroba förhållanden, det vill säga i närvaro av syre, kan detta användas som ett substrat av ett enzym som kallas den gratis dehydrogenaspyruvatet, som ska dekarboxyleras och förvandlas till acetyl-CoA, en molekyl som kan komma in i Krebs-cykeln i mitokonria eller delta i andra anabola rutter såsom fettsyrabiosyntes, till exempel.
- I frånvaro av syre eller anaerobios kan pyruvat användas av enzymlaktatdehydrogenaset för att producera mjölksyra (oxidation) genom en process som kallas "mjölkfermentering".
- Dessutom kan pyruvat omvandlas till glukos genom glukoneogenes, till alanin genom transaminas alanin, i oxalacetat med karboxylaspyruvat, etc.
Det är viktigt att komma ihåg att i reaktionen katalyserad av detta enzym inträffar nätsyntesen av ATP som räknas för glykolys, vilket producerar av varje glukosmolekyl 2 pyruvatmolekyler och 2 ATP.
Från detta perspektiv har således enzymkinaspyruvat en grundläggande roll i många aspekter av cellulär metabolism, så mycket så, som används som terapeutiskt mål för många patogener av människan, bland vilka olika protozoer sticker ut.
Reglering
Kinaspyruvatet är ett oerhört viktigt enzym från cellmetabolismens synvinkel, eftersom det är den som bildar den sista föreningen till följd av katabolismvägen för glukos: pyruvat.
Förutom att vara en av de tre mest reglerade enzymerna i hela glykolytisk väg (de andra två hexokinasen (HK) och fosfofrucerachinas (PFK)), är kinaspyruvatet ett mycket viktigt enzym för kontroll av metaboliskt flöde och produktion av ATP genom ATP genom glykolys.
Det aktiveras av fosfoenolpiruvat, ett av dess substrat (homotropisk reglering), liksom av andra mono- och diposforylerade sockerarter, även om dess reglering beror på typen av isoenzym som beaktas.
Vissa vetenskapliga texter tyder på att regleringen av detta enzym också beror på dess "multidominium" -arkitektur, eftersom dess aktivering verkar bero på vissa rotationer inom områdena för underenheterna och förändringar i geometrien för den aktiva platsen.
För många organismer beror den Árosteric aktiveringen av kinaspyruvatet på fruktos 1,6-bifosfat (F16BP), men detta är inte sant för grönsaksenzymer. Andra enzymer aktiveras också av cyklisk AMP och glukos 6-fosfat.
Kan tjäna dig: Händer: Egenskaper, struktur, funktionerDessutom har det visats att aktiviteten hos de flesta av de studerade pyruvatkinaserna beror mycket på närvaron av monovalent joner såsom kalium (K+) och divalent joner såsom magnesium (Mg+2) och mangan (Mn+2).
Hämning
Kinaspyruvatet hämmas huvudsakligen av fysiologisk effekt, så dessa processer varierar avsevärt mellan olika arter och till och med mellan typer av celler och vävnader i samma organism.
Hos många däggdjur har glukagon, epinefrin och AMPC hämmande effekter på kinaspyruvataktiviteten, effekter som kan motverkas av insulin.
Dessutom har det bevisats att vissa aminosyror som fenylalanin kan ha åtgärder som konkurrerande hämmare för detta enzym i hjärnan.

