Porinas egenskaper, funktion och montering
- 3930
- 1050
- Johan Gustafsson
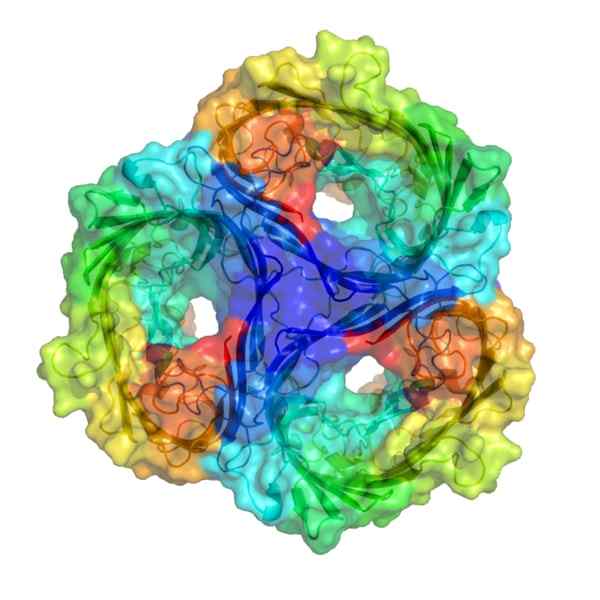
De Porin De är en typ av omfattande membranprotein som tillåter spridning av olika typer av medelstora molekyler. De finns i de yttre membranen i Gram -negativa bakterier (som i OCH. coli) och mitokondrier och kloroplaster. Dessa transmembranala proteiner överför helt membranen och deras struktur bildas av ß -ark.
Till skillnad från transportproteiner är poriner kanalproteiner, det vill säga de bildar kanaler eller öppna porer som korsar membranet där det är beläget, vilket möjliggör fri diffusion av molekyler med lämplig storlek och belastning.
 Källa: I: Användare: Zephyris [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]]
Källa: I: Användare: Zephyris [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]] [TOC]
Egenskaper
Porinor är proteiner som skapar transmembraalkanaler och till skillnad från de flesta proteiner som korsar ett membran, består den del som korsar detta membran av ß -ark istället för α propeller.
Dessa omfattande membranproteiner kan sakna en selektivitet med avseende på molekylerna som kommer att passera genom dem, eller kan presentera vissa grader av storlek och belastningsselektivitet. De kan också tillåta passage av molekyler mindre än en viss storlek.
Den polära regionen i porinkedjan är inuti som täcker den vattenhaltiga kanalen, medan den apolära delen projiceras utanför fatet och interagerar med den hydrofoba regionen i membranets lipid tvåskikt.
Diffusionen genom de kanaler som bildas av dessa proteiner beror på en koncentrationsgradient av molekylen eller ämnet som korsar membranet och är en passiv diffusion, det vill säga det kräver inte metabolisk energi för rörelsen av ämnet.
Denna diffusion styrs av specifika mekanismer som kan öppna eller stänga kanalen och kan hämmas av flera föreningar.
Kan tjäna dig: cytotrophoblast: egenskaper, utveckling och funktionStrukturera
I slutet av 1980 -talet, genom x -y -kristallografi, bestämdes den atomiska strukturen hos en porina för första gången, motsvarande cellmembranet hos Rhodobacter capsulatus som är en fotosyntetisk bakterie.
Denna porina består av en trimmer, där varje monomer bildar en ß -fat med 16 ß -ark som rullas ihop och bildar en cylindrisk struktur som kan korsa membranet och som innehåller en por full av vatten inuti inuti.
Olika typer av poriner har beskrivits sedan dess, både prokaryota och eukaryota celler. Alla består av länkade ß -ark som bildar en ß -fatstruktur och ett vatten fullt av vatten som kan mäta mellan 0,6 till 3 nm i diameter.
I mitokondrierna består porinerna av 19 ß -ark som vikade varandra p -fatet.
I många bakterier består porinerna av mellan 16 och 18 anti-parallella ß-ark som bildar ett ß-fat och presenterar vätebindningar mellan de närliggande molekylerna längs kedjan.
Fungera
Porinerna i bakterierna och membranen i mitokondrier och kloroplaster är funktionellt lika, fungerar på liknande sätt på grund av dess likhet i termer av måtten på porerna, atomstrukturen och passiva diffusionsegenskaper.
Porinkanalens bredd definieras av inriktningen av polypeptider i den inre väggen i strukturen, vilket gör det möjligt att begränsa storleken på molekylerna som kommer att passera genom dem.
Likheten mellan dessa strukturer, förstärker endosimbiotisk teori, enligt vilken mitokondrierna hos eukaryota celler kommer från en prokariotisk organisme som fagocierades av en föregångare till den eukaryota cellen.
Det kan tjäna dig: ton: egenskaper och funktionerI eukaryoter
I eukaryota celler finns de i de yttre membranen i mitokondrier och plastider. Porinor som finns i plasten har varit mycket lite studerade.
När det gäller mitokondrier är de kända som mitokondriella poriner eller spänningsberoende anjoniska kanaler (VDAC). De är breda kanaler med en ungefärlig diameter på 3Nm som utgör den största proteinbeståndsdelen i externa membran. De representerar cirka 30% av det totala proteinet i detta membran.
Generera permeabilitet för molekyler utan belastning på upp till 5000 da. Mitokondriella poriner tillåter passagen mot intermembranutrymmet för små molekyler, joner och metaboliter.
Molekylerna och jonerna som korsar intermembranalt utrymme passerar inte genom det inre mitokondriella membranet, eftersom det har större ogenomtränglighet. Därför laddas utrymmet mellan de två membranen med små molekyler och joner, som liknar cytoplasma.
I prokaryoter
I gram -negativa bakterier tillåter ett yttre membran dem att isolera sig från miljön som ett skyddsåtgärd. Detta membran innehåller permeabla för de näringsämnen som krävs av bakterier.
Du kan hitta cirka 100.000 porinor i membranet i en prokaryot cell, som representerar cirka 70% av de totala proteinerna i den strukturen.
I tarmbakterier representerar det yttre membranet skydd mot yttre skadliga medel som antibiotika, gallsalter och proteaser.
Poriner säkerställer fångst och eliminering av små hydrofila molekyler, vilket gör att cellen kan få näringsämnen som är nödvändiga för korrekt funktion och kan frigöras från avfallsprodukter. I OCH. coli, Porinor tillåter passage av disackarider, fosfater och andra små molekyler.
Montering av porinorna i eukaryoter och prokaryoter
Mitokondriella poriner importeras till mitokondrier av ett proteinkomplex som kallas TOM (extern mitokondriell membrantranslokas) och sätts in av SAM -komplexet (klassificeringsmaskiner och proteinmontering).
Kan tjäna dig: hur många celler har människokroppen?Många studier har beskrivits som vissa yttre membranproteiner av bakterier importeras till eukaryota cellmitokondrier av en mekanism som hanteras av TOM- och SAM -komplex, vilket indikerar att denna införingsprocess har bevarats mellan de två systemen.
I bakterier sätts poriner in av ett komplex som har monteringsmaskiner av ß -fat som kallas BAM. Detta komplex består av fem proteiner, varav fyra är lipoproteiner.
Även om processen för införande av poriner och deras strukturer liknar mellan eukaryota celler och prokaryoter, är en anmärkningsvärd skillnad att i prokaryoter för införandet av dessa strukturer krävs närvaron av lipoproteiner.
Å andra sidan beror dess montering i mitokondriella externa membran på närvaron av två tillbehörsproteiner från SAM -komplexet: SAM35 och SAM36 -proteiner.
Referenser
- Alberts, b., Bray, D., Watson, J. D., Lewis, J., Roberts, K. & Raff, m. (2002). Biologi av cellmolekylen. Fjärde upplagan. Ed. Kransvetenskap.
- Devlin, m. T. (1993). Texbok för biokemi med kemiska korrelationer. Ed. John Wiley & Sons, Inc.
- Lodish, h. (2005). Cellulär och molekylärbiologi. Ed. Pan -amerikansk medicin.
- Schirmer, T., & Rosenbusch, J. P. (1991). Prokaryota och eukaryota byins. Nuvarande åsikt inom strukturell biologi, 1 (4), 539-545.
- Schulz, g. OCH. (1993). Bakteriella byins: struktur och funktion. Nuvarande åsikt inom strukturell biologi, 5 (4), 701-707.
- Voet, D., & Voet, J. G. (2006). Biokemi. Ed. Pan -amerikansk medicin.
- Zeth, K., & Thein, m. (2010). Byins i prokaryoter och eukaryoter: Vanliga teman och variationer. Journalbiokemisk, 431 (1), 13-22.

