Vad är kemisk periodicitet?
- 867
- 110
- Johan Olsson
De Kemisk periodicitet Det är en trend eller mönster som uppvisar de kemiska elementen för en uppsättning av deras kemiska och fysiska egenskaper. Det blir ett slags släktskap, som var en grundläggande guide för kemiföräldrar att organisera och klassificera alla element i dagens kända periodiska tabell.
De 118 befintliga elementen (mellan naturliga och konstgjorda) håller i en annan utsträckning en relation med varandra som definierar dem i familjer eller grupper. Till att börja med tillät detta att beskriva reaktiviteterna i elementen, liksom den typ av föreningar som bildas; Och ännu bättre, förutsäga egenskaperna hos dem som ännu inte har upptäckts.
 Elementen i det periodiska tabellen
Elementen i det periodiska tabellen Sedan, medan det tjugonde århundradet och fysiken fortsatte, korrelerades dessa egenskaper med atomens elektroniska struktur. Således markerar elektroner kemisk periodicitet med avseende på elementen, men inte så mycket för deras isotoper och relativ stabilitet.
Tack vare kemisk periodicitet är det möjligt att förstå varför elementen är placerade i samma grupp i det periodiska tabellen. Det möjliggör också förutsägelse av kemiska egenskaper och till och med fysiska, bland element i olika atommassor.
[TOC]
Mönster och grupper
 Liksom sicksackmönstren för dessa moln visar elementens egenskaper en periodisk och karakteristisk tendens. Källa: Pravin Bagga/CC BY-S (https: // CreativeCommons.Org/licenser/BY-SA/3.0)
Liksom sicksackmönstren för dessa moln visar elementens egenskaper en periodisk och karakteristisk tendens. Källa: Pravin Bagga/CC BY-S (https: // CreativeCommons.Org/licenser/BY-SA/3.0) Kemisk periodicitet observeras, som förväntat, i periodiska egenskaper. Dessa kännetecknas av tendensen till deras värden när de utvärderas under en periodisk period eller grupp.
En sicksack, en såg eller ett brant berg kan väljas för jämförelseändamål: med upp- och nedgångar. Det vill säga periodiska egenskaper som har minimalt och maximalt för vissa element. Och de relativa positionerna för dessa element motsvarar briljant, med platsen i sina respektive grupper.
Det är därför kemisk periodicitet är användbar för att analysera den baserat på grupper; Men perioder är viktiga för en fullständig vision av trenden.
Kan tjäna dig: kaliumkarbonat (k2co3): struktur, egenskaper, användningar, erhållningDet kommer att ses med följande exempel på periodicitet i kemi, som inte bara vinner i de periodiska egenskaperna, utan också i de oorganiska föreningarna och, inkluderande, organiska.
Joniseringsenergi
Joniseringsenergi är, är en av de mest framstående periodiska egenskaperna. Ju större atom i ett element, desto enklare är en av dess sista elektroner att ta bort; det vill säga de från Valencia. Därför: Atomer med små radioapparater kommer att ha stora, medan atomer med stora radioapparater kommer de att ha små.
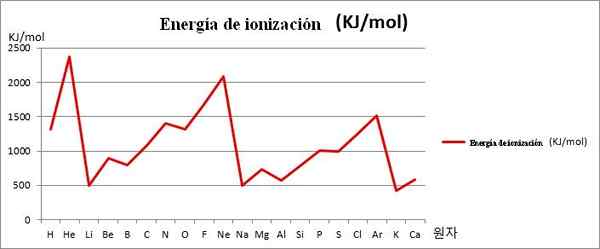 EI vs. grafik. De första 20 kemiska elementen. Källa: Kenneth.J H.Han/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0)
EI vs. grafik. De första 20 kemiska elementen. Källa: Kenneth.J H.Han/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0) Observera till exempel på bilden ovan att elementen li, na och k, har minderåriga EI, varför de är belägna i grafikens dalar eller medel. Samtidigt finns de element som han, NE och AR, finns på toppmötena eller högre punkter, eftersom deras är mycket stora i förhållande till de andra elementen.
Elementen Li, NA och K tillhör gruppen av alkaliska metaller, kännetecknade av deras EI -skadade. Å andra sidan motsvarar elementen som han, NE och AR de ädla gaserna, med mycket höga, eftersom deras atomer är de minsta bland alla elementen under samma period av det periodiska bordet.
Således indikerar kemisk periodicitet att det minskar en grupp, men ökar att turnera en period från vänster till höger.
Blockhydros p
Ett exempel på den kemiska periodiciteten utanför de periodiska egenskaperna vi ser i hydr från blockelementen p.
Till exempel består grupp 15 av element N, P, AS, SB och BI. Om det är känt att ammoniak, NH3, Den har kväve med ett oxidationsnummer +3, då är det möjligt att förväntas, med enkel periodicitet, att de återstående elementen också har liknande hydros. Och det är verkligen: NH3, PH3, Aska3, Sbh3 och Bih3.
Kan tjäna dig: Bor: historia, egenskaper, struktur, användningarEtt annat liknande fall inträffar med grupp 16. Syrehydrid är h2Eller, vatten. Det förväntas återigen att elementen S, SE, TE och PO har hydrorer med lika formler, men med abysmalt olika egenskaper. Och det är: h2S, h2Se, h2Te och h2Po. Detta beror på kemisk periodicitet.
Det kanske mest imponerande exemplet förstås av kol-, kisel- och germaniumhydros. Kolhydrid är CHO4, Och det av kisel, sih4. Germanio, som förutses av Mendeleev med namnet Eka-Silicio (ES), måste ha som periodicitet en hydrid med GEH-formel4; Förutsägelse som slutade bekräfta efter upptäckten och efterföljande studier.
Halogenmolekyler
Om det är känt att fluor är i elementärt tillstånd som en M -molekyl2, Sedan antas att de andra halogenerna (CL, BR, I och AT) också bildar diatomiska molekyler. Och det är att vara Cl -molekylerna2, Bras2 och jag2 Det mest kända.
Oxider och sulfider
På samma sätt som nämnts med blockhydrorerna p, Oxider och sulfider för element i samma grupp visar en slags korrespondens i deras respektive kemiska formler. Till exempel är litiumoxid li2Eller att vara oxider för andra alkaliska metaller eller grupp 1: NA2OKEJ2Eller RB2O och cs2ANTINGEN.
Detta beror på att i alla av dem metallerna med ett oxidationsnummer +1, interagerar med en anjon eller2-. Detsamma händer med deras sulfider: Li2S, na2S, etc. När det gäller alkalinoterösa metaller eller grupp 2 är formlerna för deras oxider och sulfider respektive: bi och BES, MGO och MGS, CAO och CAS, SRO och SRS, BAO respektive BAS.
Det kan tjäna dig: Selensyra (H2SO3): Egenskaper, risker och användningarDenna periodicitet gäller också (delvis) för blockelementens oxider p: Co2, Sio2, Geo2, B2ANTINGEN3, Till2ANTINGEN3, Ga2ANTINGEN3, etc. Men för blockelement d eller andra av blocket p, Denna periodicitet blir mer komplicerad på grund av högsta möjliga oxidationsnummer för samma element.
Till exempel tillhör koppar och silver grupp 11. En har två oxider: cuo (cu2+) och CU2Eller (cu+); Medan den andra knappt bara har en: sedan (ag+).
Kolväten och silan
Både kol och kisel har förmågan att bilda C-C respektive Si-Si-bindningar. C-C-bindningar är mycket mer stabila, så kolvätestrukturer kan bli oproportionerligt mer många och varierande än de i deras siltanska motsvarigheter.
Denna slutsats beror igen på kemisk periodicitet. Till exempel etan, cho3Ch3 eller c2H6 Disilanum har sin motsvarighet, sih3Ja H3 eller om2H6.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Helmestine, Anne Marie, PH.D. (26 augusti 2020). Periody definition i kemi. Återhämtat sig från: tankco.com
- OCH. V. Babaev, & Ray Hefferlin. (s.F.). Begreppet kemisk periodicitet:
Från Mendeleev Molecular Table Hyper-Periodicity Mönster. Återhämtad från: kem.Msu.Ru - Blommor p., Theopold K., & Langley r. (s.F.). Pil. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Det öppna universitetet. (2020). Kemiska mönster finns i periodstabellen: kemisk periodicitet. Återhämtad från: öppen.Edu

