Atomradio
- 1356
- 397
- Anders Svensson
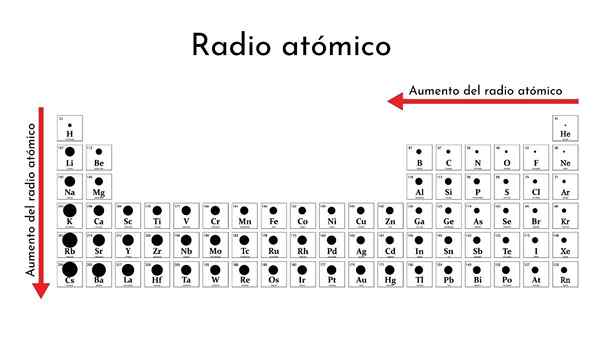
 Periodisk tabell över elementen med atomradio
Periodisk tabell över elementen med atomradio Vad är atomradio?
han atomradio Det är en viktig parameter för de periodiska egenskaperna för elementen i det periodiska tabellen. Det är direkt relaterat till storleken på atomerna, eftersom den större radio, större eller skrymmande är. På samma sätt är det relaterat till de elektroniska egenskaperna hos samma.
Medan en atom har fler elektroner, desto större är atomstorlek och radio. Båda definieras av elektronerna i Valencia -skiktet, eftersom på avstånd utöver deras banor närmar sig sannolikheten för att hitta en elektron till noll. Det motsatta förekommer i närheten av kärnan: sannolikheten för att hitta en elektron ökas.
 Bomullspaket. Det sätt på vilket de är komprimerade definierar deras storlek och radioapparater, på samma sätt som händer med atomer
Bomullspaket. Det sätt på vilket de är komprimerade definierar deras storlek och radioapparater, på samma sätt som händer med atomer Den övre bilden representerar en bomullsbollförpackning. Observera att var och en är omgiven av sex grannar, inte räknar en annan möjlig eller lägre rad. Det sätt på vilket bomullsbollar är komprimerade kommer att definiera deras storlekar och därför deras radioapparater; som med atomer.
Elementen enligt deras kemiska natur interagerar med sina egna atomer på ett eller annat sätt. Därför varierar storleken på atomradie beroende på vilken typ av bindning som finns och med den fasta förpackningen av dess atomer.
Hur mäts atomradie?
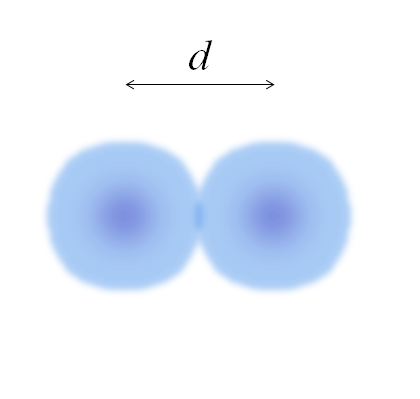 Bild av två atomer, vars kanter inte är helt definierade. Källa: Gabriel Bolívar
Bild av två atomer, vars kanter inte är helt definierade. Källa: Gabriel Bolívar I föregående bild kan det vara enkelt. Emellertid är inte en atoms sfär. Därför att? Eftersom elektroner cirkulerar och oskärpa i betongregioner i rymden: orbitaler.
Därför kan atomen betraktas som en sfär med impalpable kanter, vilket det är omöjligt att säga vart de slutar. I den överlägsna bilden ser till exempel centrumet, nära kärnan, en mer intensiv färg, medan dess kanter är suddiga.
Kan tjäna dig: solvationBilden representerar en diatomisk molekyl och2 (Som CL2, H2, ANTINGEN2, etc.). Antagande att atomer är sfäriska kroppar, om avståndet bestämdes d som separerar båda kärnorna i den kovalenta länken, det skulle då räcka för att dela upp den i två halvor (d/2) för att erhålla atomradie; Mer exakt den kovalenta radien för E för E2.
Vad händer om E inte bildade kovalenta bindningar med sig själv, men det var ett metalliskt element? Så d Det skulle indikeras av antalet grannar som omger E i sin metallstruktur; det vill säga med koordinationsnumret (n.C) av atomen inuti förpackningen (kom ihåg bildens bomullsbollar).
Bestämning av internukleär avstånd
Att bestämma d, vilket är det internukleära avståndet för två atomer i en molekyl eller förpackning, fysiska analystekniker krävs.
En av de mest använda är x -ray -diffraktion. Den utstrålar en ljusstråle genom ett glas, och diffraktionsmönstret till följd av interaktioner mellan elektroner och elektromagnetisk strålning studeras.
Beroende på förpackningen kan olika diffraktionsmönster erhållas och därför andra värden på d.
Om atomerna är "täta" i det kristallina nätverket kommer de att presentera olika värden på d jämfört med dem som skulle ha om de var "bekväma".
På samma sätt kan dessa internukleära avstånd sträcka sig från värden, så atomradie består faktiskt av ett medelvärde för sådana mätningar.
Hur relaterar atomradie och koordinationsnummer? V. Goldschmidt skapade en relation mellan de två, där för en n.C av 12, det relativa värdet är 1; av 0.97 för förpackningar där atomen har n.C lika med 8; av 0.96, för en n.C lika med 6; och 0.88 för en n.C av 4.
Kan tjäna dig: natriumpermanganat (namno4): egenskaper, riskerEnheter
Från värdena för n.C lika med 12, många av tabellerna har byggts där atomradioerna för alla element i det periodiska tabellen jämförs.
Eftersom inte alla element bildar sådana kompakta strukturer (n.C Mindre än 12) används V -förhållandet. Goldschmidt för att beräkna sina atomradio och uttrycka dem för samma förpackning. På detta sätt standardiseras mätningarna av atomradio.
Men vilka enheter som uttrycks i? Med tanke på d Det är av mycket liten storlek, enheterna i Angström Å (10 ∙ 10-10m) eller också allmänt använt, picometern (10 ∙ 10-12m).
Hur förändras du i det periodiska tabellen?
Över en tid
Atomradioerna bestäms för metallelement kallas metallradio, medan för de icke -metalliska elementen, kovalenta radioapparater (såsom fosfor, P4, eller svavel, s8). Men mellan båda typerna av radioapparater finns det en mer framträdande åtskillnad än namnet.
Från vänster till höger under samma period lägger kärnan till protoner och elektroner, men de senare är begränsade till samma energinivå (huvudantalet).
Som en följd av detta utövar kärnan en växande effektiv kärnbelastning på valenselektroner, som kontrakterar atomradie.
På detta sätt tenderar icke -metalliska element under samma period att ha mindre atomiska (kovalenta) radioapparater.
Fallande av en grupp
När de faller ned av en grupp aktiveras nya energinivåer, vilket gör att elektroner kan ha mer utrymme. Således täcker det elektroniska molnet större avstånd, dess suddiga periferi hamnar mer från kärnan, och därför expanderar atomradie.
Kan tjäna dig: hydroxylgruppLantanidsammandragning
Elektronerna i det inre skiktet hjälper till att lysa den effektiva kärnbelastningen på valenselektronerna. När orbitalerna som utgör de inre skikten har många "hål" (noder), som med f orbitalerna, kontrakterar kärnan starkt atomradie på grund av den dåliga sköldeffekten av dem.
Detta faktum bevisas i lantanidkontraktionen i period 6 i den periodiska tabellen. Från HF finns det en betydande sammandragning av atomradieprodukten från orbitalerna F, som är "fyllda" som blocket F: det från Lantanoides och Actinoids resas.
En liknande effekt kan också observeras med elementen i block P från period 4. Denna gång produkt av den svaga skärmningseffekten av D -orbitalerna som fylls genom att resa perioderna med övergångsmetaller.
Atomiska radioexempel
För period 2 av den periodiska tabellen är atomradioerna för dess element:
-Li: 257 pm
-BE: 232
-B: 88 PM
-C: 197
-N: 194
-O: 66 PM
-F: 184
Observera att litiummetallen har den största atomradie (257 pm), medan fluor, som ligger i höger ände av perioden, är den minsta av dem alla (64 PM). Atomradie går ner från vänster till höger under samma period, och noteringsvärdena visar det.
Litium, genom att bilda metallbindningar, är dess radie metallisk; och fluor, som form kovalenta bindningar (F-F), är dess radie kovalent.
Vad händer om du vill uttrycka atomradio i Angström -enheter? Det räcker för att dela dem med 100: (257/100) = 2.57 Å. Och så vidare med resten av värdena.
Referenser
- Kemi 301. Atomradier. Återhämtat sig från: CH301.centimeter.Utexas.Edu
- CK-12 Foundation (2016). Atom radie. Återhämtad från: kem.Librettexts.org
- Trender i atomradier. Taget från: intro.Kem.Okstate.Edu
- Clackamas Community College (2002). Atomstorlek. Hämtad från: DL.klapper.Edu
- Clark j. (2012). Atom- och jonradie. Återhämtat sig från: Chemguide.co.Storbritannien
- Shiver & Atkins. (2008). Oorganisk kemi (fjärde upplagan, sid. 23, 24, 80, 169). MC Graw Hill.

