Endergonreaktion

- 1568
- 398
- Hans Olsson
 En endär reaktion är den icke -spontan och det kräver mycket energi
En endär reaktion är den icke -spontan och det kräver mycket energi Vad är en endär reaktion?
En Endergonreaktion Det är en som inte är spontan och kräver också en hög energiförsörjning. I kemi är denna energi vanligtvis kalorin. Det mest kända bland alla endotermiska reaktioner är endotermiska reaktioner, det vill säga de som absorberar värme som inträffar.
Anledningen till att inte alla reaktioner är spontana beror på att de konsumerar energi, och de system som bildas av de involverade arterna minskar sin entropi. Med andra ord, för kemiska ändamål blir de molekylärt mer ordnade.
Att bygga en tegelvägg är ett exempel på en endär reaktion. Tegelstenar ensamma är inte tillräckligt kompakta för att bilda en solid kropp. Detta beror på att det inte finns någon energin som främjar sin förening (återspeglas också i dess möjliga låga intermolekylära interaktioner).
För att bygga väggen behöver du cement och arbete. Detta är energi, och den icke -spontana reaktionen (väggen kommer inte att byggas automatiskt) blir möjlig om en energifördel uppfattas (ekonomiskt, i fallet med väggen).
Om det inte finns någon fördel kommer väggen att kollapsa vid någon störning, och deras tegel kan aldrig förbli förenade. Detsamma gäller för många kemiska föreningar, vars konstruktionsblock inte kan gå med spontant.
Egenskaper för en endär reaktion
- Det är inte spontant.
- Absorbera värme (eller annan typ av energi).
Anledningen är att deras produkter har mer energi än reagensen involverade i reaktionen. Ovanstående kan representeras med följande ekvation:
ΔG = gProdukter-GReagens
Där ΔG är förändringen av Gibbs gratis energi. Som gProdukt är större (eftersom det är mer energiskt) än gReagens, Subtraktionen måste vara större än noll (ΔG> 0). Följande bild sammanfattar det nyligen förklarade:
Kan tjäna dig: natriumsulfat (Na2SO4): Struktur, egenskaper, användningar, erhållning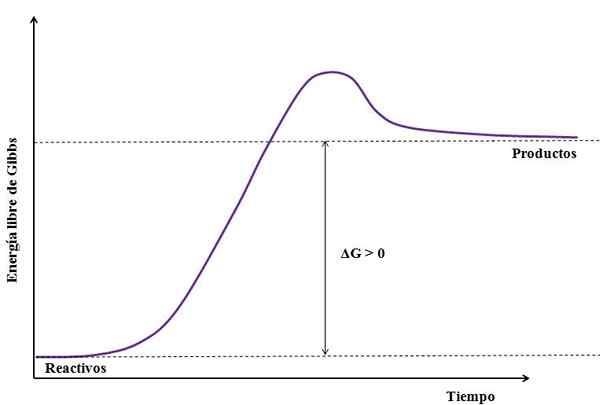 Figur av en endergonisk reaktion. Källa: Gabriel Bolívar
Figur av en endergonisk reaktion. Källa: Gabriel Bolívar Notera skillnaden mellan energitillstånd mellan produkter och reagens (lila linje). Därför förvandlas reagensen inte till produkter (a+b => c) om det inte finns någon värmeabsorption först.
Öka fri energi energi
Varje endergonisk reaktion har en ökning av systemfri energi i systemet. Om det för en viss reaktion uppfylls att ΔG> 0, kommer det inte att vara spontan och kommer att kräva att en energiförsörjning genomförs.
Hur man vet matematiskt om en reaktion är enstegonisk? Tillämpa följande ekvation:
ΔG = ΔH-tΔS
Där ΔH är entalpin av reaktionen, det vill säga den totala energin som släpps eller absorberas, är ΔS förändring av entropi och t temperaturen. TΔS -faktorn är förlust av energi som inte utnyttjas i utvidgningen eller ordningen av molekylerna i en fas (fast, vätska eller läsk).
Således är ΔG den energi som systemet kan använda för att utföra ett jobb. Eftersom ΔG har ett positivt tecken för en endär reaktion, måste energi eller arbete (reagens) tillämpas för att få produkterna.
Så att känna till ΔH -värdena (positiva, för en endoterm reaktion och negativ, för en exoterm reaktion) och TΔS, kan du veta om reaktionen är slut -gononisk.
Detta betyder att även om en reaktion är endotermisk, Nej Det är nödvändigtvis endogoniskt.
Isen kub
Till exempel smälter en isbit i flytande vattenabsorberande värme, vilket hjälper till att separera dess molekyler; Processen är emellertid spontan och därför är det inte en endär reaktion.
I händelse av att isen är grundad vid en temperatur långt under -100 ° C, blir termen TΔS för den fria energiekvationen liten jämfört med ΔH (eftersom T minskar), och som ett resultat kommer ΔG att ha positivt värde.
Kan tjäna dig: karboxylsyraMed andra ord: Smält isen under -100 ° C är en enstegonisk process, och den är inte spontan. Ett liknande fall är att frysa vatten runt 50 ° C, vilket inte inträffar spontant.
Länkarna för deras produkter är svagare
En annan viktig funktion, också relaterad till ΔG, är energin i nya länkar. Länkarna för de bildade produkterna är svagare än reagensen.
Minskningen av länkarnas kraft kompenseras emellertid med en massförstärkning, vilket återspeglas i de fysiska egenskaperna.
Här börjar jämförelsen med tegelväggen förlora betydelsen. Enligt ovanstående måste staplarna inuti tegelstenarna vara starkare än de mellan dem och cementet. Väggen som helhet är dock mer styv och motståndskraftig att ha större massa.
Det är i kombination med exergononiska reaktioner
Om slut -talande reaktionerna inte är spontana, hur sker de i naturen? Svaret beror på koppling med andra reaktioner som är ganska spontana (exergoniska) och som på något sätt främjar deras utveckling.
Till exempel representerar följande kemisk ekvation denna punkt:
A + B => C (Endergonic Reaktion)
C + d => e (exergonon reaktion)
Den första reaktionen är inte spontan, så naturligtvis kunde det inte hända. Produktionen av C tillåter emellertid att den andra reaktionen inträffar, orsakar och.
Lägga till Gibbs gratis energier för de två reaktionerna, ΔG1 och ΔG2, Med ett resultat mindre än noll (ΔG<0), entonces el sistema presentará un incremento de la entropía y, por lo tanto, será espontáneo.
Det kan tjäna dig: hydrorOm C inte reagerade med D, kunde jag aldrig bilda det, för att jag inte hade energikompensation (som fall med pengar med tegelväggen). Det sägs då att C och D "Jalan" till A och B för att reagera, till och med att vara en enstegonisk reaktion.
Exempel på endergoniska reaktioner
Fotosyntes
Växter använder solenergi för att skapa kolhydrater och syre från koldioxid och vatten. Co₂ och o2, Små molekyler med starka länkar, bildar sockerarter, av tarry -strukturer, som är tyngre, solida och smälter vid en temperatur runt 186 ° C.
Observera att C-C-, C-H- och C-O-länkarna är svagare än för O = C = O och O = O. Och från en sockerenhet kan växten syntetisera polysackarider, såsom cellulosa.
Syntes av biomolekyler och makromolekyler
Endermaniska reaktioner är en del av anabola processer. Liksom kolhydrater kräver andra biomolekyler, såsom proteiner och lipider, komplexa mekanismer som utan dem, och i kombination med hydrolysreaktionen hos ATP, kunde det inte finnas.
Bildandet av diamanter och tunga föreningar av råolja
Diamanter kräver enorma tryck och temperaturer, så att deras komponenter kan kompakta i ett kristallint fast ämne.
Vissa kristallisationer är emellertid spontana, även om de passerar med mycket långsamma hastigheter (spontanitet är inte relaterad till reaktionens kinetik).
Slutligen representerar råolja ensam en produkt av endergoniska reaktioner, särskilt tunga kolväten eller makromolekyler som kallas asfaltens.
Deras strukturer är mycket komplexa, och deras syntes behöver mycket tid (miljoner år), värme och bakteriell åtgärd.
Andra exempel
- Cellulär andning av växter.
- Syre transport i blodomloppet.
- Diffusionen av joner genom cellmembran.
- Muskelsammandragning.
- Cellproteinsyntes.
Referenser
- Endermaniska och exeroniska reaktioner. Återhämtat sig från Quimitube.com
- Fri energi. Återhämtad från ES.Khan akademin.org
- Definition av endergonisk reaktion. Hämtad från biologi.netto

