Organiska salter
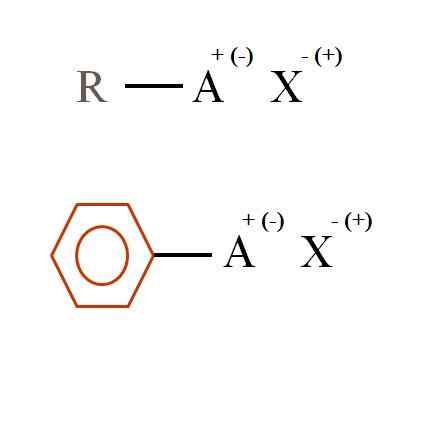
- 2136
- 113
- PhD. Lennart Johansson
 Två allmänna kemiska formler för organiska salter. Källa: Gabriel Bolívar
Två allmänna kemiska formler för organiska salter. Källa: Gabriel Bolívar Vad är organiska salter?
De Organiska salter De är ett tätt antal joniska föreningar med otaliga funktioner. Tidigare härrörande från en organisk förening, som har genomgått en omvandling som gör att den kan vara en last, och att dess kemiska identitet beror på den tillhörande jonen.
I den överlägsna bilden visas två mycket allmänna kemiska formler för organiska salter. Den första, R-AX, tolkas som en förening i vars kolstruktur en atom, eller grupp A, bär en positiv + eller negativ belastning (-).
Som man kan se finns det en kovalent bindning mellan R och A, R-A, men i sin tur har den en formell belastning som lockar (eller avvisar) till jonen X. Lasttecknet beror på arten av A och den kemiska miljön.
Om det var positivt, hur många X kunde interagera? Med en, med tanke på principen om elektronutralitet (+1-1 = 0). Men vad är identiteten på x? Anjon x kan vara co32-, kräver två katjoner ra+; En halogenid: f-, Kli-, Bras-, etc.; eller till och med en annan förening-. Alternativen är oöverskådliga.
På samma sätt kan ett organiskt salt vara aromatiskt, illustrerat i den benseniska bruna ringen. Kopparbensoatsalt (ii), (c6H5Kuttra)2CU består till exempel av två aromatiska ringar med negativt laddade karboxgrupper, som interagerar med katjonen CU2+.
Fysiska och kemiska egenskaper hos organiska salter
Från bilden kan det bekräftas att organiska salter består av tre komponenter: den organiska, r eller ar (den aromatiska ringen), en atom eller gruppbärare av jonbelastningen a och en motion x.
Precis som kemisk identitet och struktur definieras av sådana komponenter, på samma sätt beror deras egenskaper på dem.
Från detta faktum kan vissa allmänna egenskaper som uppfyller de allra flesta av dessa salter sammanfattas.
Kan tjäna dig: oxidationsnummer: koncept, hur man får ut det och exempelHögmolekylmassor
Förutsatt att mono eller mångsidiga oorganiska anjoner har vanligtvis mycket större molekylmassor än oorganiska salter. Detta beror främst på kolsyrat skelett, vars enkla C-C-bindningar, och dess väteatomer, ger mycket massa till föreningen.
Därför är de de ansvariga för sina höga molekylmassor.
Amfifyl- och ytaktiva medel
Organiska salter är amfifila föreningar, det vill säga deras strukturer har både hydrofila och hydrofoba ytterligheter.
Vad är sådana ytterligheter? R eller AR representerar det hydrofoba änden, eftersom deras atomer av C och H inte har stor affinitet för vattenmolekyler.
TILL+(-), Atom- eller lastbärargruppen är den hydrofila änden, eftersom den bidrar till dipolmomentet och interagerar med vattnet som bildar dipol (RA+ Åh2).
När hydrofila och hydrofoba regioner är polariserade blir amfifiliskt salt ett ytaktivt medel, ett ämne som används allmänt för utarbetande av tvättmedel och obefläckad.
Höga kokpunkter eller fusion
Liksom oorganiska salter har organiska salter också höga smält- och kokpunkter på grund av de elektrostatiska krafterna som styr i flytande eller fast fas.
Men med en organisk komponent R eller AR, andra typer av van der Waals (London, Dipolo-dipolo, vätebroar) deltar på något sätt med elektrostatisk.
Av denna anledning är de fasta eller flytande strukturerna för organiska salter i första hand mer komplexa och varierade. Några av dem kan till och med bete sig som flytande kristaller.
Surhet och basicitet
Organiska salter är vanligtvis starkare syror eller baser än oorganiska salter. Detta beror på att till exempel i aminsalter har den en positiv belastning på grund av dess koppling till ett extra väte: a+-H. Sedan, i kontakt med en bas, donera protonen för att vara en neutral förening igen:
Det kan tjäna dig: strontium: historia, struktur, egenskaper, reaktioner och användningarRa+H + b => ra + hb
H tillhör A, men är skriven, eftersom den ingriper i neutraliseringsreaktionen.
Å andra sidan, RA+ Det kan vara en stor molekyl som inte kan bilda fasta ämnen med ett kristallint nätverk stabilt med hydroxylanjon eller oxhydrilo OH-.
När detta är så, salt ram+Åh- Det uppträder som en stark bas; Även lika grundläggande som NaOH eller KOH:
Ra+Åh- + Hcl => racl + h2ANTINGEN
Notera i den kemiska ekvationen att anjonen cl- ersätta oh-, bildar salt RA+Kli-.
Användning av organiska salter
Användningen av organiska salter varierar beroende på identiteten på R, AR, A och X. Dessutom beror applikationen till vilken de tilldelas också på vilken typ av fast eller vätska. Vissa generaliteter i detta avseende är:
- De fungerar som reagens för syntes av andra organiska föreningar. RAX kan fungera som en "giver" av R -kedjan för att lägga till en annan förening som ersätter en bra utgående grupp.
- De är ytaktiva medel, så de kan också användas som smörjmedel. Metallkarboxylalatsalter används för detta ändamål.
- De tillåter att syntetisera ett brett spektrum av färgämnen.
Exempel på organiska salter
Karboxylater
Karboxylsyror reagerar med en hydroxid i en neutraliseringsreaktion, vilket orsakar karboxylalatsalter: RCOO- M+; där m+ Det kan vara vilken metallisk katjon+, Pb2+, K+, etc.) eller ammonium NH -katjon4+.
Fettsyror är långkedjiga karboxylsyror, de kan vara mättade och omättade. Palmitinsyra är bland de mättade (välj3(Ch2)14Cooh). Detta härstammar palmitatsaltet, medan stearinsyran (Cho3(Ch2)16COOH bildar stear salt. Tvålar består av dessa salter.
Kan tjäna dig: allmän gaslagNär det gäller bensoesyra, c6H5COOH (där C6H5- Det är en bensenring), när den reagerar med en bas bildar salter av bensoat. I alla karboxilater gruppen -co- Representerar A (RAX).
Litiumdiaquilcupratos
Litiumdagen är användbar vid organisk syntes. Dess formel är [R-CU-R]-Li+, där kopparatomen bär en negativ belastning. Här representerar kopparens atom på bilden.
Sulfoniumsalter
De bildas av reaktionen av en organisk sulfid med en alkylhalogenid:
R2S + r'x => r2R+X
För dessa salter har svavelatomen en positiv formell belastning (s+) att ha tre kovalenta länkar.
Oxyiosalter
På samma sätt reagerar etrar (de syresatta analogerna i sulfiderna) med hydraceiderna för att bilda oxyrummen:
Ror ' + hbr ro+Hr ' + br-
HBR -syran är konsekvent kopplad till eterens syreatom (R2ANTINGEN+-H), laddar det positivt.
Amina salter
Aminer kan vara primära, sekundära, tertiära eller kvartära, precis som deras salter. Alla kännetecknas av att ha en atom av H kopplad till kväveatomen.
Således, RNH3+X- Det är ett primärt aminsalt; R2Nh2+X-, av sekundär amina; R3Nh+X-, av tertiär amin; och r4N+X-, av kvartära amin (kvartära ammoniumsalt).
Diazoniumsalter
Slutligen diazoniumsalter (RN2+X-eller arildiazonium (RNA2+X-), de representerar utgångspunkten för många organiska föreningar, särskilt de azoiska färgämnena.
Referenser
- Francis A. Sköldpaddsskal. Organisk kemi (sjätte upplagan, sid. 604-605, 697-698, 924). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. Organisk kemi. Amines (10: e upplagan.). Wiley Plus.
- Wikipedia (2018). Salt (kemi). Taget från: i.Wikipedia.org
- Steven a. Hardinger (2017). Illustrerad ordlista för organisk kemi: salter. Återhämtad från: kem.Ucla.Edu
- Chevron Oronite (2011). Karboxylater. [Pdf]. Återhämtat sig från: oronit.com

