Selenhistoria, egenskaper, struktur, erhållning, användning

- 3826
- 1217
- Johan Olsson
han selen Det är en icke -metallisk kemikalie som tillhör grupp 16 i den periodiska tabellen och representeras av symbolen är. Detta element har mellanliggande egenskaper mellan svavel och telurio, som är medlemmar i samma grupp.
Selenen upptäcktes 1817 av Jöhs J. Berzelius och John G. Gahn, som förångade pyriten observerade en röd rest (lägre bild). Först förvirrade de honom med Telurio, men insåg sedan att de stod inför ett nytt element.
 En flaska med amorft rött selen, den mest kända alotropiska för detta element. Källa: W. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
En flaska med amorft rött selen, den mest kända alotropiska för detta element. Källa: W. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Berzelius kallade det nya elementet som selen, baserat på namnet "Selene" som betyder "Moon Goddess". Selen är ett viktigt spår för växter och djur, även om det i höga koncentrationer är ett giftigt element.
Selenen har tre huvudsakliga allotropiska former: röd, svart och grå. Det senare har egenskapen att modifiera sin elektriska ledningsförmåga baserat på intensiteten på ljuset som utstrålar det (fotokonduktor), så den har haft många tillämpningar.
Selenen är allmänt fördelad i jordskorpan, men mineralerna som innehåller det är inte rikligt, så det finns ingen gruvutnyttjande av selen.
Det erhålls huvudsakligen som en sekundär produkt av raffineringsprocessen genom kopparelektrolys. Selen ackumuleras i slem som är vid anoden av elektrolysceller.
Människor har cirka 25 seleenoproteiner, av vilka några uppfyller en antioxidantverkan och kontrollerar genereringen av fria radikaler. Det finns också selenaminosyror, såsom selenomektion och selenocystein.
[TOC]
Historia
Första observationen
Alchemisten Arnold från Villanova kan ha observerat selenen 1230. Detta bildades inom medicin i Sorbonne i Paris och var till och med doktorn på påven Clemente V.
Villanova i sin bok Rosariumfilosoforum Beskriv ett rött svavel eller "svavelavskjutning" som hade förblivit i en ugn efter att ha förångat svaveln. Denna röda svavel kunde ha varit en alotropik av selen.
Upptäckt
1817 upptäckte Jöhs Jakob Berzelius och John Gottlieb Gahn selen i en kemisk växt för produktion av svavelsyra, nära Gripsholm, Sverige. Råmaterialet för utarbetandet av syran var pyrit, som extraherades från en Falun -gruva.
Berzelius slogs av förekomsten av en röd rest som förblev i blybehållaren efter att svavel hade bränt.
Berzelius och Gahn konstaterade också att den röda återstoden hade en stark lukt av kryddig rädisa, liknande den som presenterades av Telurio. Anledningen till varför han skrev till sin vän Marect att de trodde att den observerade insättningen var en telurioförening.
Blelius fortsatte emellertid att analysera det deponerade materialet genom att förbränna pyriten och ompröva att Telurio inte hade hittats i Falun. Drog slutsatsen i februari 1818 att han hade upptäckt ett nytt element.
Ursprunget till ditt namn
Berzelius påpekade att det nya elementet var en kombination av svavel och telurio, och att likheten mellan Telurio med det nya elementet hade gett honom möjlighet att namnge det nya selenämne.
Berzelius förklarade att "Tellus" betyder gudinnan på jorden. Martin Klaport 1799 placerade detta namn till Telurio och skrev: ”Inget element kallas bara på det sättet. Det måste göras!".
På grund av likheten mellan Telurio med det nya ämnet kallade Berzelius det med ordet selen, härrörande från det grekiska ordet "selene" som betyder "månens gudinna".
Utveckling av dina applikationer
1873 upptäckte Willoughby Smith att den elektriska konduktiviteten som presenterades av selenen berodde på ljuset som strålade det. Den här egenskapen gjorde det möjligt för Selen att ha många applikationer.
Alexander Graham Bell 1979 använde selen i sin fotofon. Selen producerar en elektrisk ström proportionell mot intensiteten i ljuset som lyser upp det, med hjälp av ljusmätare, säkerhetsmekanismer för öppning och stängning av dörrar etc.
Användningen av selen likriktare i elektronik började från 1930 -talet, med många kommersiella applikationer. På 1970 -talet ersattes han i likriktarna för kisel.
1957 upptäcktes att selen var ett väsentligt element för livet för däggdjur, eftersom det var närvarande i enzymer som skyddar mot reaktiva syre och fria radikaler. Dessutom upptäcktes förekomsten av aminosyror som selenometionin.
Fysiska och kemiska egenskaper
Utseende
Det finns flera alotroper för selen, deras fysiska utseende varierar. Det presenteras vanligtvis som ett rödaktigt fast ämne i form av damm.
Standardatomvikt
78.971 U
Atomantal (z)
3. 4
Smältpunkt
221 ºC
Kokpunkt
685 ºC
Densitet
Selendensitet varierar beroende på vilken alotropisk eller polymorf beaktas. Några av dess bestämda tätheter vid rumstemperatur är:
Grå: 4 819 g/cm3
Alfa: 4,39 g/cm3
Vitreous: 4,28 g/cm3
Flytande tillstånd (smältpunkt): 3,99 g/cm3
Fusionsvärme
Grå: 6.69 kJ/mol
Förångningsvärme
95,48 kJ/mol
Molorisk kapacitet
25 363 J/(mol · k)
Oxidationsnummer
Selen kan kopplas i dess föreningar som manifesterar följande siffror eller oxidationstillstånd: -2, -1, +1, +2, +3, +4, +5, +6. Bland dem är de viktigaste -2 (2-), +4 (jag vet4+) och +6 (jag vet6+).
Kan tjäna dig: Enkelt mikroskopTill exempel i SEO2 Selen har +4 oxidationsnummer; det vill säga katjonens existens4+ (HAN4+ANTINGEN22-). Liknar SEO3 Selen har +6 oxidationsnummer (i6+ANTINGEN32-).
I väte seleniuro, h2SE, selenen har oxidationsnummer -2; det är återigen förekomsten av jon eller anjon antas2- (H2+HAN2-). Detta beror på att selen är mer elektronegativ än väte.
Elektronnegativitet
2.55 på Pauling -skalan.
Joniseringsenergi
-Först: 941 kJ/mol.
-Andra: 2.045 kJ/mol.
-Tredje: 2.973,7 kJ/mol.
Magnetisk ordning
Diamagnetisk.
Hårdhet
2.0 på Mohs -skalan.
Isotoper
Det finns fem naturliga och stabila isotoper av selen, som visas nedan med deras respektive överflöd:
-74SE (0,86%)
-76SE (9,23%)
-77SE (7,6%)
-78SE (23,69%)
-80SE (49,8%)
Allotropi
 Svart flaska belagd med en tunn film av selengrå. Källa: W. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Svart flaska belagd med en tunn film av selengrå. Källa: W. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Selen som framställts i kemiska reaktioner är ett rött amorft pulver i tegel, som när den vitre svarta formen är grundad, liknande Rosario -konton (överlägsen bild). Svart selen är ett sprött och glansigt fast ämne.
Dessutom är svart selen något lösligt i kolsulfid. När denna lösning värms upp vid 180 ° C, fälls det grå selenet, den mest stabila och täta alotropiska.
Grå selen är resistent mot oxidation och är inert mot verkan av icke -oxiderande syror. Huvudegenskapen för detta selen är dess fotokonduktivitet. Att vara upplyst ökar sin elektriska konduktivitet med en faktor 10 till 15 gånger.
Reaktivitet
Selen i dess föreningar finns i oxidationstillstånd -2, +4 och +6. Manifesterar en tydlig tendens att bilda syror i högre oxidationstillstånd. Föreningarna som har selen med oxidationstillståndet -2 kallas seleniuros (2-).
Vätereaktion
Selen reagerar med väte för att bilda väte seleniuro (h2Se), en färglös, brandfarlig och illaluktande gas.
Syrereaktion
Selenen brinner genom att avge en blå låga och bilda selendioxid:
HAN8 (S) + 8 o2 => 8 SEO2 (S)
Selenoxid är en polymer, vit och fast substans. Dess hydrering producerar selenös syra (h2SEO3). Selen bildar också selentrioxid (SEO3), Analog med svavel (så3).
Reaktion med halogener
Selenen reagerar med fluor för att bilda selen hexafluoruro:
HAN8 (S) +24 f2 (g) => 8 sef6 (L)
Selenen reagerar med klor och brom för att bilda diklorid respektive dysilenium -dibromure:
HAN8 (S) +4 Cl2 => 4 se2Kli2
HAN8 (S) +4 BR2 => 4 se2Bras2
Selen kan också bilda SEF4 och SECL4.
Å andra sidan bildar selenen föreningar där en atom av selen ansluter sig till en av halogen och en annan syre. Ett viktigt exempel är selenoxiklorid (SEO2Kli2), Med selen i oxidation +6, ett extremt kraftfullt lösningsmedel.
Reaktion med metaller
Selen reagerar med metaller för att bilda aluminium, kadmium och natriumseleniuros. Kemikalien för nedan motsvarar bildningen av aluminiumseleniuro:
3 SE8 + 16 Al => 8 till2HAN3
Selenitas
Selenen bildar salter som kallas Selenitas; Till exempel: Silver Selenite (Ag2SEO3) och natriumselenit (NA2SEO3). Detta namn har i ett litterärt sammanhang använts för att hänvisa till månens invånare: The Selenitas.
Syror
Den viktigaste selensyran är tätningssyra (h2SEO4). Den är lika stark som svavelsyra och reduceras lättare.
Elektronisk struktur och konfiguration
- Selen och dess länkar
Selenet har sex elektroner i Valencia, varför det ligger i grupp 16, samma som syre och svavel. Dessa sex elektroner finns i 4S- och 4P -orbitaler, enligt deras elektroniska konfiguration:
[AR] 3D10 4S2 4p4
Därför, liksom svavel, bildar två kovalenta bindningar för att slutföra sin oktett av Valencia; Även om den har tillgänglighet av sina 4D -orbitaler att koppla mer än två atomer. Således närmar sig tre selenatomer och bildar två kovalenta bindningar: se-se-se.
Selen med sin större atommassa har en naturlig tendens att bilda strukturer som styrs av kovalenta bindningar; Istället för att ordnas som diatomiska molekyler2, SE = SE, analog med O2, O = O.
- Ringar eller kedjor
Bland de molekylära strukturerna som antagits av selenatomer kan två nämnas i allmänna termer: ringar eller kedjor. Observera att i SE: s hypotetiska fall3, Atomer krävs fortfarande av ändarna; Därför måste de länka till andra atomer, tills kedjan kan stängas i en ring.
De vanligaste ringarna är de av åtta medlemmar eller selenatomer:8 (En selenitkrona). Varför åtta? Eftersom ju mindre ringen, desto större kommer spänningen att drabbas; Det vill säga vinklarna på deras länkar avviker från de naturliga värden som ställs av deras SP -hybridiseringar3 (liknande som med cykloalcanos).
Kan tjäna dig: pascal sprutaDet finns åtta atomer, separationen mellan SE-atomerna räcker för att deras länkar ska vara "avslappnade" och inte "vikta"; Även om vinkeln på dess länkar är 105,7 och inte 109.5. Å andra sidan kan det finnas mindre ringar: i6 och7.
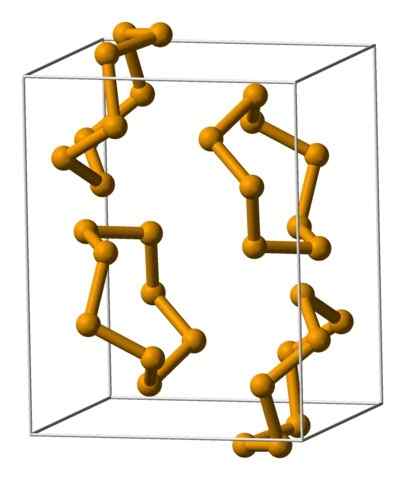 Selenanalerenheter representerade med en modell av sfärer och staplar. Källa: Benjah-Bmm27 [Public Domain].
Selenanalerenheter representerade med en modell av sfärer och staplar. Källa: Benjah-Bmm27 [Public Domain]. I den övre bilden visas analysenheterna8. Notera den likhet som de har med svavelkronorna; Bara de är större och tunga.
Förutom ringarna kan selenatomer också ordnas i spiralformade kedjor (tänk på snigelstrappor):
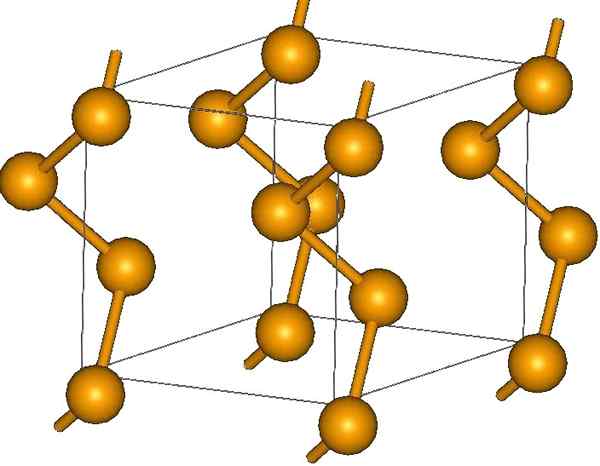 Spiralformade selenkedjor. Källa: MaterialScientist på English Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Spiralformade selenkedjor. Källa: MaterialScientist på English Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] I dess ändar kan det finnas dubbla terminallänkar (-se = SE), eller ringar är8.
- Alotroper
Med hänsyn till att det kan finnas selen spiralformade ringar eller kedjor, och att deras dimensioner också kan variera beroende på antalet atomer de innehåller, är det uppenbart att det finns mer än en alotrop för detta element; Detta är rena selenfasta ämnen men med olika molekylstrukturer.
Rött selen
Bland de mest framträdande alotroperna av selen har vi röda, som kan presenteras som ett amorft damm, eller som monokliniska och polymorfa kristaller (se bilden av ringarna är8).
I det amorfa röda selenet är strukturer oordning utan uppenbara mönster; Medan i linsen upprättar ringarna en monoklinisk struktur. Det kristallina röda selenet är polymorf och har tre faser: α, ß och y, som skiljer sig åt i deras täthet.
Svart selen
Strukturen för det svarta selenet består också av ringar; Men inte åtta medlemmar, men många fler, det finns upp till ringar på tusen atomer (1000). Det sägs då att dess struktur är komplex och består av polymera ringar; några större eller små än andra.
När det finns polymerringar i olika storlekar är det svårt att vänta på att en strukturell ordning ska upprättas; Så det svarta selenet är också amorft, men i motsats till det rödaktiga dammet som nämns ovan har det glasartade sammanhang, även om det är sprött.
Grå selen
Och slutligen, av selenens enklaste alotroper är grå, som sticker ut över andra genom att vara den mest stabila under normala förhållanden, och även ha ett metalliskt utseende.
Deras kristaller kan vara hexagonala eller trigonala, etablerade av Londons dispersionskrafter mellan deras polymera spiralformade kedjor (överlägsen bild). Vinkeln på dess länkar är 130,1 º, vilket indikerar en positiv avvikelse av de tetraedriska miljöerna (med vinklar på 109,5 °).
Det är därför Selenium spiralformade kedjor ger intrycket av att vara "öppen". Genom evighet, i denna struktur konfronteras atomerna, så i teorin måste det finnas en större överlappning av deras orbitaler för att skapa drivande band.
Värme med ökningen av molekylära vibrationer skadar dessa band när kedjorna är oordning; Medan en fotons energi direkt påverkar elektroner, spännande dem och marknadsför sina transaktioner. Från denna vision är det "lätt" att föreställa sig fotokonduktivitet för selengrå.
Var är och produktion
Även om det är allmänt distribuerat är selen ett sällsynt element. Det är i infödda tillstånd förknippade med svavel och mineraler som Eucairita (Cuagse), Cloustalita (PBSE), Naumanite (AG AG2SE) och Crookesite [(Cutiag)2HAN].
Selen finns som en förorening som ersätter svavel i en liten del av metall svavelösa mineraler; som koppar, bly, silver, etc.
Det finns jord där selen finns i den lösliga formen av selenat. Dessa bärs av regnens vatten till floderna och därifrån, mot havet.
Vissa växter kan absorbera och koncentrera selen. Till exempel innehåller en kopp nötter i Brasilien 544 μg selen, en mängd motsvarande 777% av mängden selen rekommenderas dagligen.
I levande varelser finns selen i vissa aminosyror, såsom: selenometionin, selenocystein och metylselenocystein. Selenocystein och selenit reduceras till väte Seleniuro.
Kopparelektrolys
Det finns ingen gruvutnyttjande av selen. Det mesta erhålls som en sekundär produkt av raffineringsprocessen genom kopparelektrolys, som är i silt som ackumuleras i anoden.
Det första steget består av selendioxidproduktion. För detta behandlas anodisk smal med natriumkarbonat för att producera dess oxidation. Sedan tillsattes selenoxiden vatten och den surgörs för att bilda selensyran.
Slutligen är det den selenösa syran med svaveldioxid för att producera dess reduktion och få det elementära selenet.
I en annan metod i blandningen av silt och lera som bildas vid produktion av svavelsyra erhålls ett orent rött selen som upplöses i svavelsyra.
Selensyra och säljsyra bildas sedan. Denna seleniska syra får samma behandling som den tidigare metoden.
Klor kan också användas, som verkar på metallseleniuros för att producera flyktiga selenklorerade föreningar; som: Jag vet2Kli2, SECL4, SECL2 och seocl2.
Kan tjäna dig: kemisk nivåDessa föreningar, i en process som utförs i vattnet, blir selenös syra, som behandlas med svaveldioxid för att frigöra selen.
Biologiskt papper
Brist
Selen är ett viktigt spår för växter och djur, vars brist på människor har orsakat allvarliga störningar som Keshans sjukdom; En sjukdom som kännetecknas av hjärtskador.
Dessutom är selenbrist associerad med manlig infertilitet och kan spela en roll i Kashin-Becks sjukdom, en typ av artros. På samma sätt har en selenbrist observerats vid reumatoid artrit.
Enzymatisk kofaktor
Selen är en komponent i enzymer med antioxidantverkan, såsom glutationsperoxidas och tioresodoxinreduktas som verkar i eliminering av ämnen med reaktivt syre.
Dessutom är Selenium en kofaktor av sköldkörtelhormoner desiodinaser. Dessa enzymer är viktiga för att reglera funktionen av sköldkörtelhormoner.
Användningen av selen har indikerats vid behandlingen av Hasimotos sjukdom, en autoimmun sjukdom med bildandet av antikroppar mot sköldkörtelceller.
Selen har också använts för att minska de toxiska effekterna av kvicksilver, eftersom några av dess verkningar utövas på selenberoende antioxidantenzymer.
Proteiner och aminosyror
Mannen har cirka 25 seleenoproteiner som utövar en antioxidantverkan för skydd mot oxidativ stress, initierat av ett överskott av reaktiva syrearter (ROS) och reaktiva kvävearter (Ni).
Närvaron av aminosyror Selenomethytheocin och selenocystein hos människor har upptäckts. Selenomektion används som ett kosttillskott i behandlingen av selenbristtillstånd.
Risker
En hög selen kroppskoncentration kan ha många skadliga effekter på hälsan, börjar med sprött hår och spröda naglar, till hudutslag, värme, hudödem och svår smärta.
När man hanterar selen i kontakt med ögonen kan människor uttrycka eld, irritation och tår. Samtidigt kan långvarig exponering för en rök med högt seleninnehåll orsaka lungödem, vitlöksandedräkt och bronkit.
Dessutom kan personen uppleva pneumonit, illamående, frossa, feber, halssmärta, diarré och hepatomegali.
Selen kan interagera med andra läkemedel och kosttillskott, såsom antacida, antineoplastiska läkemedel, kortikosteroider, niacin och piller för födelsekontroll.
Selen har förknippats med en ökad risk för att drabbas av hudcancer. I en studie av National Cancer Institute påpekades att män med hög selen kroppskoncentration hade dubbelt så mycket sannolikhet för att lida av aggressiv prostatacancer.
En studie indikerar att det dagliga intaget av 200 ug selen, ökar med 50% möjligheten att utveckla en typ II -diabetes.
Ansökningar
Kosmetika
Selensulfid används vid behandling av seborré, såväl som fet eller mjäll.
Läkare
Det används som en alternativ medicin vid behandling av Hasimotos sjukdom, en autoimmun sköldkörtelsjukdom.
Selen minskar toxiciteten hos kvicksilver, vars en av dess toxiska aktiviteter utövas på deoxidantenzymer, som använder selen som en kofaktor.
Manganelektrolys
Användningen av selenoxid i manganelektrolys minskar avsevärt kostnaderna för tekniken, eftersom elektrisk konsumtion minskar.
Pigment
Selen används som pigment i målningar, plast, keramik och glas. Beroende på selenen som använde glasets färg varierar från en djup röd till en ljusorange.
Fotokediös
På grund av egenskapen hos det grå selenet för att ändra dess elektriska konduktivitet beroende på ljusets intensitet som utstrålar det har selenen använts i fotokopiatorer, fotociper, fotometrar och solceller.
Användningen av selen i fotokopiatorer var en av de viktigaste selenapplikationerna; Men utseendet på organiska fotokonduktorer har minskat användningen.
Kristaller
Selen används för missfärgning av glaset, som ett resultat av närvaron av järn som ger en grön eller gul färg. Dessutom tillåter det en röd färgfärg, beroende på den användning du vill ge det.
Vulkanisering
Dietenio Dietenium används som ett vulkaniserande medel för gummiprodukter.
Legeringar
Selen används i kombination med vismut i mässingen för att ersätta bly; Mycket giftigt element som har minskat användningen på grund av rekommendationerna från hälsobyråer.
Selen tillsätts till låga koncentrationer till stål- och kopparlegeringar för att förbättra användarvänligheten av dessa metaller.
Rätta
Selen -likriktare började användas 1933 fram till 1970 -talet, då de ersattes av kisel med låg kostnad och högre kvalitet.
Referenser
- Royal Australian Chemical Institute. (2011). Selen. [Pdf]. Återhämtat sig från: raci.org.Au
- Wikipedia. (2019). Selen. Hämtad från: i.Wikipedia.org
- Sato kentaro. (s.F.). Nya allotroper av huvudgruppselement. [Pdf]. Hämtad från: tCichemicals.com
- Doktor. Deg Stewart. (2019). Selenelement fakta. Kemikkolis. Återhämtat sig från: Chemicool.com
- Robert C. Hårbåt. (28 augusti 2019). Selen. Encyclopædia Britannica. Återhämtat sig från: Britannica.com
- Marques Miguel. (s.F.). Selen. Återhämtat sig från: nautilus.Fis.Uc.Pt
- Helmestine, Anne Marie, PH.D. (3 juli 2019). Selenfakta. Återhämtat sig från: tankco.com
- Lentech B. V. (2019). Period Tabell: Selen. Återhämtat sig från: Lentech.com
- Tinggi u. (2008). Selen: dess roll som antioxidant i människors hälsa. Miljöhälsa och förebyggande medicin, 13(2), 102-108. Doi: 10.1007/S12199-007-0019-4
- Kontor för kosttillskott. (9 juli 2019). Selen: Faktablad för hälso- och sjukvårdspersonal. National Institute of Health. Hämtad från: SDG.Va.Nih.Gov

