Stötdämparlösningar

- 4727
- 1272
- Per Karlsson
Vi förklarar vilka dämpningslösningar, deras egenskaper, komponenter, typer och ger flera exempel
 De stötdämpande lösningarna reglerar pH runt ett specifikt värde
De stötdämpande lösningarna reglerar pH runt ett specifikt värde Vad är dämpningslösningar?
De stötdämparlösningar, Även kallade buffertar, pH- eller buffertaregulatorer är vattenlösningar som bildas av svag syra och dess konjugatbas eller en svag bas och dess konjugerade syra.
De kallas stötdämpande lösningar, eftersom de har förmågan att dämpa förändringen av pH efter tillsats av syror eller baser i små mängder, även om det är starka syror eller baser.
Stötdämparen är mycket användbara, eftersom de tillåter pH att vara konstant. Det finns många kemiska reaktioner som behöver ett specifikt och konstant pH för att fungera bra.
Egenskaper hos de morpainära lösningarna
De är vattenhaltiga lösningar
Både pH -konceptet och pH -skalan är bara vettiga i vattenhaltiga lösningar, så alla buffertar eller dämpningslösningar är beredda i vatten.
Driften är baserad på syrabasens jämvikt och principerna för Le Chatlier
Buffertar är baserade på reversibla syra/basdissocieringsreaktioner som är i jämvikt. Genom att lägga till starka syror eller baser i miljön störs denna balans, så systemet reagerar för att motverka störningen, efter principerna från Le Catelier. Så här lyckas buffertar dämpa de stora förändringarna i pH.
Ditt pH beräknas enkelt med Henderson-Haselbalch-ekvation
Oavsett vilken typ av stötdämpande lösning, dess pH både före och efter tillsats av små mängder starka syror eller baser, kan den beräknas med hjälp av Henderson-Hohaselbalch-ekvationen:
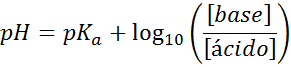
Där [bas] hänvisar till den molära koncentrationen av basen (eller saltet av konjugatbasen) och [syra] avser den molära koncentrationen av syran (eller av saltet av den konjugerade syran)).
Kan tjäna dig: elastiska materialDe kan delvis neutralisera både syror och baser
Dämpningslösningarna består av ett grundläggande ämne och ett surt substans, som kan neutralisera baser respektive syror. Av denna anledning kan de dämpa pH efter tillsats av både starka syror och starka baser.
Driften beror på temperaturen
PH för en buffertlösning beror på surheten eller den grundläggande konstanten för syran eller den svaga basen som den innehåller. Denna konstant beror på temperaturen, så driften av dessa lösningar beror också på temperaturen.
Ju mer koncentrerad, desto större är dess förmåga att dämpa eller reglera pH
Dämpningskapaciteten beror på den totala koncentrationen av lösningen är större än den slutliga koncentrationen av syran eller den starka basen som tillsätts. Av denna anledning, ju större den totala koncentrationen av buffertlösningen, desto större är dess förmåga att dämpa syror eller starka baser.
Komponenter i en dämpning eller buffertlösning
Kemiskt bildas dämpningslösningar av endast två komponenter. Dessa komponenter kan vara en svag syra blandad med ett salt från dess konjugatbas eller en svag bas blandad med ett salt av dess konjugerade syra.
Det finns två olika sätt att få dessa komponenter i samma lösning, som vi kommer att se nedan:
1. Förberedelse av buffertarnas blandningslösningar av dess komponenter
Detta är det mest direkta sättet att förbereda en buffertlösning. För att göra detta framställs separata lösningar av svag syra (till exempel ättiksyra) och ett konjugerat bassalt (till exempel natriumacetat) separata lösningar)). Då blandas båda lösningarna gradvis tills det önskade pH.
Det kan tjäna dig: jon ammonium (NH4+): formel, egenskaper och användningar
- Lösningar blandas lite tills det önskade pH
2. Beredning av buffertar genom partiell neutralisering av en lösning av en svag syra
I detta fall framställs en svag syralösning med önskad total koncentration, och sedan tillsätts natrium- eller kaliumhydroxid lite efter att ha nått det önskade pH.
Typer av buffertlösningar
Stötdämparen kan klassificeras enligt vilka typer av komponenter de har eller enligt deras slutliga pH.
Enligt typerna av komponenter:
- Svag och konjugerad basbuffert: I dessa fall beror pH på PKtill av svag syra.
- Svag basbuffert och konjugerad syra: I dessa fall beror pH på PKb svag.
- Polyprotic Acid Salts Buffer: I vissa fall är både rollen som svag syra och dess konjugatbas båda salter från partiell neutralisering av en syra som har flera protoner såsom svavelsyra eller fosforic.
Enligt dess slutliga pH:
Beroende på surhet eller baskonstant kan en buffertlösning reglera pH runt olika pH -intervall, vilket ger upphov till tre typer av buffertar:
- Syrabuffertar: Är de som reglerar pH runt värden lägre än 7. De är beredda med svaga syror vars PKtill vara mindre än 7 eller med svaga baser vars PKb vara större än 7.
- Neutrala buffertar: Är de som reglerar pH runt 7. De består vanligtvis av svaga syror eller baser som har en PKtill eller en PKb Nära 7.
- Alkaliska buffertar: Är de som reglerar pH runt värden större än 7. De är beredda med svaga syror vars PKtill vara större än 7 eller med svaga baser vars PKb är mindre än 7.
Exempel på buffertar eller dämpningslösningar
Ättiksyrabuffert/natriumacetat
Detta är en buffert av en svag syra (ättiksyra) och ett salt av dess konjugatbas (natriumacetat). Balansen involverad och dess jämviktskonstant är:
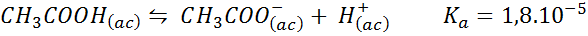
Denna buffert reglerar pH runt 4.74.
Ammoniakbuffert/ammoniumklorid
Detta är en svag basbuffert (ammoniak eller ammoniumhydroxid) och ett salt av dess konjugerade syra (ammoniumklorid). Balansen involverad och dess jämviktskonstant är:
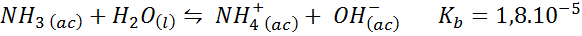
Detta är en alkalisk buffert som reglerar pH runt 9.26.
Bisulfat/sulfatbuffert
I detta fall spelar bisulfatjonen papperet om svag syra vars konjugatbas är sulfatjonen. Balansen är:
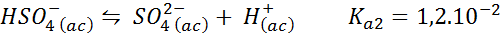
Detta är en syramammande lösning som reglerar pH runt 3.05.
Kolsyra/bikarbonatbuffert
Detta är ett av de viktigaste pH -regleringssystemen i vårt blod. Reaktionen är: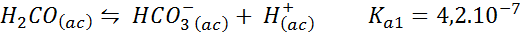
Denna buffert reglerar pH runt 6.38.
Dihydrogenbuffertfosfat/vätefosfat
Detta är ett av de mest använda pH -regleringssystemen inom biologi och biokemi, eftersom det gör det möjligt att reglera pH mycket nära det fysiologiska pH som de flesta kemiska reaktioner inom celler inträffar. Reaktionen är:
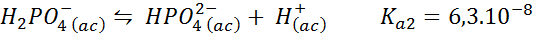
Denna buffert reglerar pH runt 7.20.

