Natriumsulfat (Na2SO4) struktur, egenskaper, användningar, erhållning

- 4279
- 650
- Per Karlsson
han natriumsulfat Det är ett oorganiskt salt vars kemiska formel är na2Sw4. Den består av ett vitt fast ämne, närvarande i tre former: vattenfri, heptohydrat (av liten existens) och DecayRoper (som kallas Glaubert Salt); Det senare är den vanligaste formen av natriumsulfat.
Natriumsulfat förfallna, NA2Sw4· 10 timmar2Eller, det upptäcktes 1625 av Glaubert i vattnet på en vår, som utsåg det saltabilis (mirakulöst salt) på grund av dess medicinska egenskaper.
 Klockglas med natriumsulfatprov. Källa: Walkerma via Wikipedia.
Klockglas med natriumsulfatprov. Källa: Walkerma via Wikipedia. Natriumsulfat har många tillämpningar inom textil- och pappersindustrin, liksom inom glasstillverkning. Dess användningar utvidgas med termiska applikationer, som inkluderar miljöförsörjningen av värme och kylning av bärbara datorer.
Natriumsulfat är en förening av låg toxicitet och dess skadliga handlingar, de är i grunden mekaniska och icke -kemiska. Av kristallografiska skäl2Sw4, presenterar ramverk och polymorfa strukturer.
[TOC]
Strukturera
Vatten-
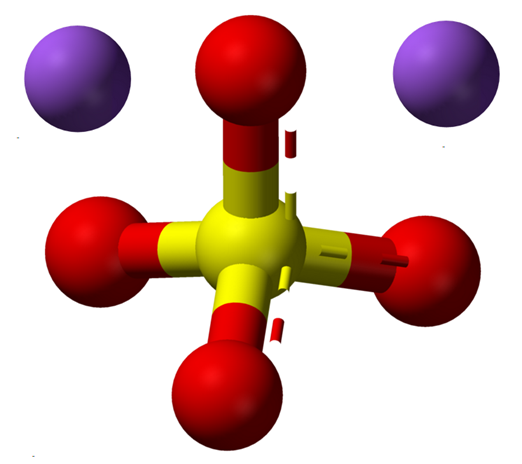 Vattenfri natriumsulfatjoner. Källa: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Vattenfri natriumsulfatjoner. Källa: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] NA -formeln2Sw4 Indikerar en gång najonerna i saltkristaller+ Och så42- De är i en 1: 2 -relation; det vill säga för varje två katjoner na+ det finns en anjon så42- interagera med dem genom elektrostatisk attraktion (överlägsen bild).
Naturligtvis gäller detta NA2Sw4 Vattenfri, utan vattenmolekyler koordinerade med natrium inuti kristallerna.
 Natriumsulfat
Natriumsulfat Trots att det är ett enkelt utseende är dess beskrivning strukturellt komplex. Då en2Sw4 Den presenterar polymorfism, med upp till fem kristallina faser: I, II, III, IV och V, vars övergångstemperaturer är 180, 200, 228, 235 respektive 883 ºC.
Även om det inte finns några referenser som certifierar det, NA2Sw4Jag måste vara den som har en hexagonal kristallin struktur, tätare jämfört med den na ortorrombiska2Sw4Iii, i vars kristaller NA+ Tetrahedra Form (Nao4) och oktaedros (Nao6) samordning; det vill säga det kan omges av fyra eller sex anjoner så42-.
Förfallna salt
Under tiden den monokliniska kristallina strukturen i dess viktigaste hydrat, NA2Sw4· 10 timmar2Eller det är enklare. I den är det praktiskt taget vattenmolekylerna som interagerar eller samordnar med NA+ I octahedra na (h2ANTINGEN)6+, Med så42- Knappt bidrar med tillräcklig stabilitet till glaset för att existera i en solid fas.
Det kan tjäna dig: första kemirevolutionenEmellertid visar dess smältpunkt (32,38 ºC) mycket lägre än för vattenfritt salt (884 ºC) hur vattenmolekyler och deras vätebroar försvagar joniska interaktioner, starkare, i Na2Sw4.
Egenskaper
Namn
-Natriumsulfat (IUPAC)
-Glauber salt (dehydrat)
-Sala Miraculous (DecoyRoper)
-Ödre sulfat.
Molmassa
142.04 g/mol (anh¡dro)
322.20 g/mol (dechydrat)
Fysiskt utseende
Vit hygroskopiskt kristallint fast ämne
Lukt
Toalett
Smak
Bitter och saltlösning
Densitet
2 664 g/cm3 (vattenfri)
1 464 g/cm3 (Dahydrat)
Observera hur vattenmolekyler inuti kristallerna får dem att utvidgas och därför minska deras densitet.
Smältpunkt
884 ºC (vattenfri)
32,38 ºC (dechydrat)
Kokpunkt
1.429 ºC (vattenfri)
Vattenlöslighet
4,76 g/100 ml (0 ºC)
13,9 g/100 ml (20 ºC)
42,7 g/100 ml (100 ºC)
Alla löslighetsvärden motsvarar vattenfritt salt, vilket är ganska lösligt i vatten i alla temperaturer.
Löslighet ökar plötsligt mellan 0 ºC och 38,34 ºC, vilket observerar att i detta temperaturområde ökar lösligheten mer än 10 gånger. Från 32,38 ºC är dock lösligheten oberoende av temperaturen.
Det händer att vid temperatur 32,8 ºC förfaller natriumsulfat upplöses i sitt eget kristallina vatten. Därför en balans mellan decayydratsalt, anhydra -salt och den mättade lösningen av natriumsulfat.
Så länge tre -fas -tillståndet upprätthålls förblir temperaturen konstant, vilket gör att termometrarnas temperatur kan kalibrera.
Å andra sidan är lösligheterna för heptahydratsalt:
19,5 g/100 ml (0 ºC)
44,0 g/100 ml (20 ºC)
Observera att vid 20 ° C är heptahydratsaltet tre gånger mer lösligt än vattenfritt.
Brytningsindex
1 468 (vattenfri)
1 394 (dechydrat)
Stabilitet
Stabil under rekommenderade lagringsförhållanden. Oförenlig med starka syror och baser, aluminium och magnesium.
Sönderfall
När det värms upp till sönderdelning avger den en toxisk rök av svaveloxid och natriumoxid.
pH
En vattenlösning på 5 % har ett pH på 7.
Reaktivitet
Natriumsulfat dissocierar i vattenlösning i 2 NA+ Och så42-, vilket gör att sulfatjonen kan kombineras med BA2+ För att fälla ut bariumsulfat. Det hjälper praktiskt att flytta bariumjonerna av vattenprover.
Kan tjäna dig: TransaminationNatriumsulfat blir natriumsulfid genom reaktion vid höga temperaturer med kol:
Na2Sw4 + 2 c => na2S +2 CO2
Glauberts salt, Naso4.10 timmar2O reagerar med kaliumkarbonat för att producera natriumkarbonat.
Ansökningar
Pappersindustri
Natriumsulfat används vid tillverkning av pappersmassa. Det används i utarbetandet av Kraft -papper, som inte innehåller lignin eller underkastar blekningsprocessen, anledningen som ger det stort motstånd. Dessutom används det i kartongtillverkning.
Tvättmedel
Det används som syntetiskt tvättmedelsfyllningsmaterial för användning hemma, vilket lägger till tvättmedel för att minska ytspänningen.
Glas
Det används i glasstillverkning för att minska eller eliminera närvaron av små luftbubblor i smält glas. Dessutom eliminerar Slags -bildningen under den smälta glasförädlingsprocessen.
Textilindustri
Natriumsulfat används som en mordant, eftersom det underlättar interaktionen mellan färgämnen med tygfibrer. Detahydratiserat natriumsulfat används i färgtestet.
Dessutom används natriumsulfat som ett färgämneutspädningsmedel och hjälpfärgat tryckmedel; såsom direkta färgämnen, svavelfärgämnen och andra medel som gynnar bomullsfärgning. Det används också som en agent som försenar de direkta färgämnena.
Medicin
Decahrid -natriumsulfat används som ett laxermedel, eftersom det är lite absorberat i tarmen och därför förblir i ljuset av detta som orsakar en volymökning. Detta stimulerar ökningen av peristaltiska sammandragningar som inducerar utvisning av tarminnehåll.
Natriumsulfat är en motgift för att kontrollera förgiftning med barium och blysalter. Glaubert Salt är effektivt för eliminering av vissa mediciner som överdrivet inträffade; Till exempel paracetamol (acetoaminophen).
Dessutom används det för att förse dåliga elektrolyter med närvaro i isoosmotiska lösningar.
Torkmedel
Natriumsulfat eftersom det är ett inerta -reagens, används för avlägsnande av vatten från organiska sammansatta lösningar.
Råmaterial
Natriumsulfat används som råmaterial för produktion av många ämnen, inklusive: natriumsulfid, natriumkarbonat och ammoniumsulfat.
Kan tjäna dig: gaskromatografiErhållande
Natriumsulfat erhålls genom gruvdrift och kemiska reaktioner.
Gruvdrift
Det finns tre malm eller mineraler som utnyttjas med kommersiell prestanda: Thenardita (NA2Sw4), Mirabilita (na2Sw4· 10 timmar2O) och glaubarita (na2Sw4·Fall4).
I Spanien utnyttjas Thenardita och Mirabilita -insättningarna av underjordisk gruvdrift av gallerier och pelare. Samtidigt erhålls glauberita utomhus, av stora flottar som placeras på mineralbehållaren.
Terrängen är beredd med sprängning av låg intensitet för att producera en porositet som möjliggör natriumsulfatlakning. Produktionsfasen inträffar med sprinklerbevattning med färskt vatten från glauberita, vars lakning sprider sig på ett fallande sätt.
Natriumsulfat saltlake samlas in, kalciumsulfatresten fylls.
Kemisk produktion
Natriumsulfat erhålls under produktionen av saltsyra genom två processer: Mannheim -processen och Hardgrenave -processen.
Mannheim process
Det görs i stora stålugnar och med en 6 m stålreaktionsplattform. Reaktionen inträffar mellan natriumklorid och svavelsyra:
2 naCl +h2Sw4 => 2 hcl +na2Sw4
Härdningsprocess
Det involverar reaktionen av natriumklorid, svaveloxid, syre och vatten:
4 NaCl + 2 Så2 + ANTINGEN2 + 2 h2O => 4 hcl +na2Sw4
Andra
Natriumsulfat förekommer i neutraliseringsreaktionen mellan natriumhydroxid och svavelsyra:
2 NaOH +H2Sw4 => Na2Sw4 + H2ANTINGEN
Natriumsulfat är en biprodukt av produktionen av många föreningar. Det extraheras från det utsläppta flytande avfallet under produktionen av viskosen och cellofanen. Även i produktionen av natriumdikromat, fenoler, borsyra och litiumkarbamat.
Risker
Natriumsulfat betraktas som en förening av låg toxicitet. Det kan dock ge en viss skada på personen som använder den olämplig.
Till exempel kan du orsaka ögonirritation, rodnad och smärta. I huden kan det orsaka irritation och allergi hos vissa människor. Dess intag kan orsaka irritation i matsmältningskanalen med illamående, kräkningar och diarré. Och slutligen ger inandning irritation i luftvägarna.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2019). Natriumsulfat. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). Natriumsulfat. Pubchemdatabas. CID = 24436. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- B. N. Mehrotra. (1978). NA: s kristallstruktur2Sw4Iii. Återhämtat sig från: rruff-2.geo.Arizona.Edu
- Glauberita-tenardita (natriumsulfat). [Pdf]. Återhämtat sig från: igme.är
- « Zinkoxid (ZnO) struktur, egenskaper, användningar, risker
- Laktofenolblå egenskaper, sammansättning, beredning, användningar »

