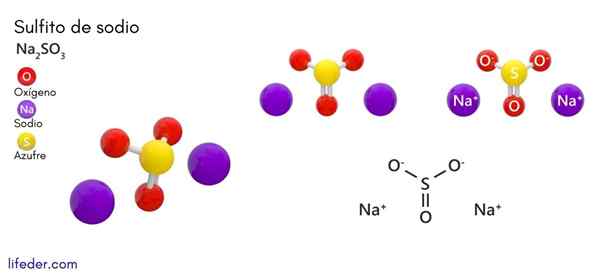
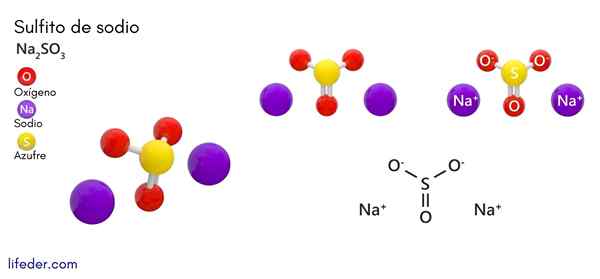
Natriumsulfit (Na2SO3)
- 3444
- 303
- Erik Eriksson
Vad är natriumsulfit?
han natriumsulfit eller natriumsulfit, vars kemiska formel är na2Sw3, Det är ett lösligt natriumsalt som erhålls som en produkt av svavelsyrareaktion (eller svaveloxid (IV)) med natriumhydroxid.
Mellan 1650 och 1660 började glauber tillverka natriumsulfit från vanligt salt (NaCl) och koncentrerad svavelsyra. Denna process betraktas som början på den kemiska industrin.
Sulfitprocessen producerar trämassa, som observeras som nästan ren cellulosafiber genom att använda flera svavelsyrasalter för att extrahera lignin från träsplinter.
Således har sulfiter ett stort antal tillämpningar av olika typer, inklusive i livsmedelsindustrin som tillsatsmedel. Bland dess mest relevanta funktioner är dess enzymatiska och icke -enzymatiska brunning, kontroll och hämning av mikrobiell tillväxt, förebyggande av oxidativ rotning och modifiering av de reologiska egenskaperna hos mat.
Natriumsulfitberedning
I allmänhet inträffar i laboratorieskala natriumsulfit från reaktionen av natriumhydroxidlösning med svaveldioxidgas (2NAOH + SO2 → Na2Sw3 + H2ANTINGEN).
Då utvecklingen av SO2 Genom att tillsätta några droppar koncentrerad saltsyra kommer det att indikera om natriumhydroxid nästan saknas, förvandlas till vattenhaltigt natriumsulfit (NA2Sw3 + 2HCl → 2NACL + SO2 + H2ANTINGEN).
Å andra sidan erhålls denna kemiska förening industriellt genom att reagera sulfiddioxid med en natriumkarbonatlösning.
Kan tjäna dig: spektral notationDen initiala kombinationen genererar natriumbisulfit (NAHSO3), Att genom att reagera med natriumhydroxid eller natriumkaroxid omvandlas den till natriumsulfit. Dessa reaktioner kan sammanfattas i den globala reaktionen så2 + Na2Co3 → Na2Sw3 + Co2.
Kemisk struktur
Alla former av natriumsulfit kännetecknas av att vara vita, kristallina och hygroskopiska fasta ämnen, som har förmågan att lätt locka och behålla vattenmolekyler i den omgivande miljön, som normalt finns vid rumstemperatur.
Typen av kristallin struktur är kopplad till närvaron av vatten i föreningen. Anhydrid natriumsulfit uppvisar en ortorrombisk eller hexagonal struktur och om det finns en närvaro av vattenmolekyler i föreningen ändrar dess struktur (till exempel heptahydratatriumsulfit en monoklinisk struktur)).
Egenskaper
Denna art har vissa fysiska och kemiska egenskaper som skiljer den från andra salter, som beskrivs nedan:
Kemiska egenskaper
Som mättad vattenlösning har detta ämne ett ungefärligt pH på 9. Dessutom oxiderar lösningarna för luften så småningom natriumsulfat.
Å andra sidan, om natriumsulfiten hos den vattenhaltiga lösningen får kristallisera vid rumstemperatur eller lägre, gör det det som en hapthydrat. Heptahydrater kristaller slår ut i varm och torr luft, de oxiderar också i luften för att bilda sulfat.
I detta avseende är anhydraform mycket mer stabil mot luftoxidation. Sulfit är oförenlig med syror, starka oxidanter och höga temperaturer. Det är också olösligt i ammoniak och klor.
Kan tjäna dig: isopropylalkoholFysikaliska egenskaper
Anhydrid natriumsulfit har en molmassa av 126,43 g/mol, en densitet av 2 633 g/cm3, En fusionspunkt på 33,4 ° C (92,1 ° F eller 306,5 K), en kokpunkt på 1 429 ° C (2 604 ° F eller 1 702 K), och är inte brandfarlig. Löslighet (mätt vid en temperatur av 20 ° C) är också 13,9 g/100 ml.
Användning/applikationer
På grund av dess reaktiva egenskaper är natriumsulfit mycket mångsidig och använder för närvarande allmänt typer av industrier.
- Det används ofta vid vattenbehandling och eliminering av upplöst syre i vattenpannor.
- Det har också applikationer inom pappersbranschen (halvkuddmassa).
- I fotografering används det vid tillverkning av avslöjande.
- I lämplig grad används det i livsmedels- och antioxidantbevarande.
- I textilindustrin används den i tvätt- och antiklorprocesser.
- Det används också som reducerande medel.
- Dessutom används det i den sekundära återhämtningen av oljebrunnar.
- Det används till och med vid tillverkning av organiska föreningar, färgämnen, bläck, viskösa rayon och gummi.
- Det används vid tillverkning av många kemikalier, inklusive kaliumsulfat, natriumsulfit, natriumsilikat, natriumhyposulfit och natriumaluminiumsulfat.
Risker
Effekter för exponering för förening
Långvarig eller upprepad exponering för detta ämne kan orsaka dermatit och känslighetsreaktioner. Exponering i sulfitkänslig, astmatisk och atopisk.
På liknande sätt kan syran sönderdelningen av natriumsulfit frisätta toxisk och farlig rök av svaveloxider, inklusive svaveldioxid, vilket kan orsaka permanent lungförsämring på grund av kronisk och akut exponering.
Kan tjäna dig: ididio 192På liknande sätt är akut förgiftning med svaveldioxid sällsynt eftersom gas lätt upptäcks. Det är så irriterande att kontakten inte kan tolereras.
Bland symtomen ingår hosta, rykt, nysningar, rivning och andningssvårigheter. Emellertid kan anställda med hög oundviklig exponering drabbas av viktiga och eventuellt dödliga lungskador.
Ekotoxicitet
Natriumsulfit är en icke -farlig lösning, som vanligtvis används som ett återstående vattennedgångsmedel. Höga koncentrationer bidrar till hög efterfrågan på kemiskt syre i vattenmiljöer.
Matförbrukning med konserveringsmedel
Ett av tillsatserna som kan orsaka problem hos känsliga människor är den grupp som kallas sulfitationsmedel, som inkluderar flera oorganiska tillsatser av sulfit (E220-228), inklusive natriumsulfit (så2).
I överkänsliga eller astmatiska människor, konsumtion av livsmedel med sulfiter eller inandning av svaveldioxid, kan det vara giftigt.
Dessa föreningar är ansvariga för bronchbegränsning som innebär andningssvårigheter. Den enda behandlingen för denna överdrivna reaktion är att undvika mat och dryck som innehåller sulfiter.