Termokemi

- 2345
- 336
- Anders Svensson
Vi förklarar att det är termokemi, vilka studier, dess lagar och tillämpningar
 I termokemin studeras värmemodifieringar i kemiska reaktioner
I termokemin studeras värmemodifieringar i kemiska reaktioner Vad är termokemi?
De Termokemi Det ansvarar för studien av värmemodifieringarna som genomförs i reaktionerna mellan två eller flera kemiska arter. Det betraktas som en väsentlig del av termodynamik, som studerar omvandlingen av värme och andra typer av energi för att förstå riktningen i vilken processerna utvecklas och hur dess energi varierar.
Det är också viktigt att förstå att värmen involverar överföring av termisk energi som uppstår mellan två kroppar, när dessa är vid olika temperaturer; Medan termisk energi är förknippad med den slumpmässiga rörelsen som atomer och molekyler har.
Därför, eftersom nästan alla kemiska reaktioner, absorberas eller frigörs genom värme, är analysen av fenomenen som inträffar genom termokemi mycket relevant.
Vilka studerar termokemi?
Termokemin studerar värmen förändras i form av värme som förekommer i kemiska reaktioner eller när processer som innebär fysiska transformationer inträffar.
I detta avseende måste vissa begrepp klargöras inom ämnet för en större förståelse av samma.
Systemet
Till exempel hänvisar termen "system" till det specifika segmentet i universum som studeras, som förstås som "universum" övervägandet av systemet och dess omgivningar (allt externt för detta).
Så ett system består i allmänhet av de arter som är involverade i de kemiska eller fysiska transformationerna som förekommer i reaktioner. Dessa system kan klassificeras i tre typer: öppna, stängda och isolerade:
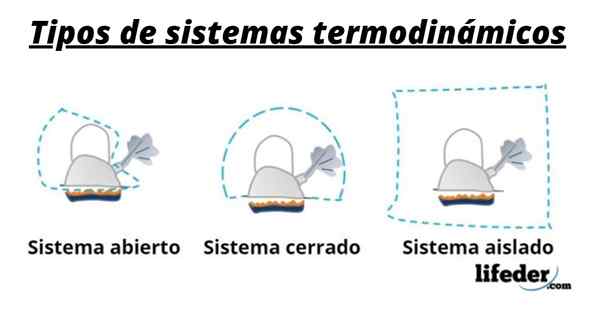
- Ett öppet system är ett som tillåter överföring av materia och energi (värme) med sin omgivning.
- I ett stängt system finns energiutbyte men inte av materia.
- I ett isolerat system presenteras inte överföringen av materia eller energi i form av värme. Dessa system är också kända som "adiabatiska".
Termokemi lagar
 Germain Hess, skapare av Hess's Law, grundläggande för termokemi
Germain Hess, skapare av Hess's Law, grundläggande för termokemi Termokemiets lagar är nära kopplade till Laplace och Lavoisiers lag, liksom Hess's Law, som är föregångarna till den första termodynamikens lag.
Principen som anges av den franska Antoine Lavoisier (viktig kemisk och ädla) och Pierre-Simon Laplace (berömd matematiker, fysisk och astronom) granskar att ”förändringen i energin som manifesteras i någon fysisk eller kemisk omvandling har samma och meningsfulla och meningsfulla Storlek i motsats till förändringen i energin från den omvända reaktionen ".
Hessrätt
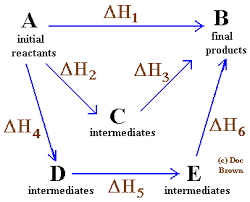
 Enkelt och allmänt diagram där Hess -lagen för fyra kemiska reaktioner tillämpas
Enkelt och allmänt diagram där Hess -lagen för fyra kemiska reaktioner tillämpas I samma idéordning är lagen som formulerats av den ryska kemisten från Schweiz, Germain Hess, en hörnsten för förklaringen av termokemi.
Denna princip är baserad på dess tolkning av lagen om energibesparing, som hänvisar till det faktum att energi inte kan skapas eller förstöras, endast omvandlas.
Hess lag kan promulgeras på detta sätt: "Den totala entalpin i en kemisk reaktion är densamma, oavsett om reaktionen genomförs i ett enda steg som om det händer i en sekvens av flera steg".
Total entalpi inträffar när subtraktionen mellan summan av entalpin av produkter utom summan av reaktanternas entalpi.
När det gäller förändring i standard entalpi i ett system (i standardförhållanden på 25 ° C och 1 atm) kan det schematiseras enligt följande reaktion:
Kan tjäna dig: klorogensyraΔHreaktion = ΣΔh(Produkter) - ΣΔh(Reaktanter)
Ett annat sätt att förklara denna princip, att veta att förändringen av entalpi hänvisar till värmeförändringen i reaktionerna när de ges till ett konstant tryck, säger att förändringen i ett systems netto entalpi inte beror på den väg som följer mellan det ursprungliga tillståndet och slutet.
Första lagen om termodynamik
Denna lag är så i sig kopplad till termokemin att den ibland är förvirrad vilken som inspirerade den andra; Så för att ge ljus på denna lag måste man börja med att säga att den också har sina rötter i principen om energibesparing.
Så att termodynamik inte bara tar hänsyn till värme som en form av energiöverföring (som termokemi), utan också involverar andra former av energi, såsom inre energi (ELLER).
Så variationen i den inre energin i ett system (ΔU) ges av skillnaden mellan dess initiala och slutliga tillstånd (som ses i Hess -lagen).
Med hänsyn till att intern energi består av kinetisk energi (partikelrörelse) och potentiell energi (interaktioner mellan partiklar) i samma system kan det dras att det finns andra faktorer som bidrar till studien av tillståndet och egenskaperna för varje system.
Termokemi applikationer
Termokemin har flera applikationer, några av dessa kommer att nämnas nedan:
- Bestämning av energiförändringar i vissa reaktioner genom användning av kalorimetri (mätning av värmeförändringar i vissa isolerade system).
- Avdrag för entalpiförändringar i ett system, även om de inte kan bli kända genom en direkt mätning.
- Analys av värmeöverföringar producerade experimentellt när organometallföreningar med övergångsmetaller bildas.
- Studie av energitransformationer (i värme) som ges i föreningar av koordination av polyaminer med metaller.
- Bestämning av entalpierna för metall-syre-länken för ß-Dics och ß-Dics förenade till metaller.
- Förutom i tidigare applikationer kan termokemi användas för att bestämma ett stort antal parametrar associerade med andra typer av energi- eller tillståndsfunktioner, som är de som definierar statusen för ett system vid en given tidpunkt.
- Termokemi används också i studien av många sammansatta egenskaper, som i titreringskalorimetri.
Referenser
- Wikipedia. (s.F.). Termokemi. Hämtas från.Wikipedia.org
- Chang, R. (2007). Kemi, nionde upplagan. Mexiko: McGraw-Hill.
- Librettexts. (s.F.). Termokemi - en recension. Erhållet från kem.Librettexts.org
- Tyagi, s. (2006). Termokemi. Återhämtat sig från böcker.Google.co.gå
- Ribeiro, m. TILL. (2012). Termokemi och dess tillämpningar på kemiska och biokemiska system. Erhållet från böcker.Google.co.gå
- Singh, n. B., Das, s. S., Och Singh,. K. (2009). Fysisk kemi, volym 2. Återhämtat sig från böcker.Google.co.gå

