Treoninegenskaper, funktioner, nedbrytning, fördelar
- 4635
- 1451
- PhD. Emil Svensson
De Treonina (Thr, T) eller Treo-a-amino-p-butyric acid är en av de beståndsdelande aminosyrorna i cellproteiner. Eftersom man och andra ryggradsdjur inte har biosyntetiska rutter för sin produktion, betraktas Treonine som en av de 9 essentiella aminosyrorna som måste förvärvas med kosten.
Treonine var den sista av de 20 vanliga aminosyrorna som upptäcktes i proteiner, ett faktum som ägde rum i historien mer än ett sekel efter upptäckten av asparagin (1806), som var den första aminosyran som beskrivs.
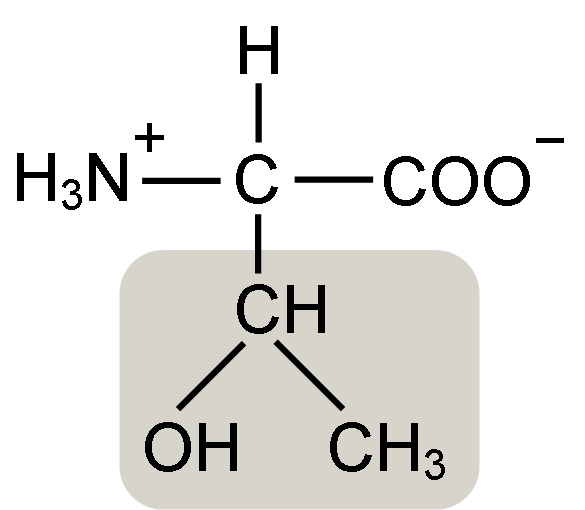
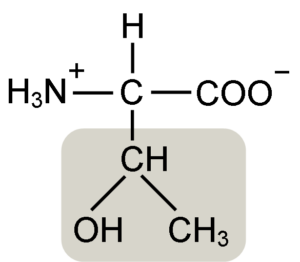 Treonine aminosyrastruktur (källa: keycin [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons)
Treonine aminosyrastruktur (källa: keycin [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons) Det upptäcktes av William Cumming Rose 1936, som myntade termen "Treonine" för den strukturella likheten som han hittade mellan denna aminosyra och Haraonsyra, en förening härrörande från Treose Sugar.
Som aminosyraprotein har treonin flera funktioner i cellerna, bland vilka bindningsstället för kolhydratkedjor som är typiska för glykoproteiner och igenkänningsstället för proteinkinaser med specifika funktioner (treoninkroteiner/serinkinaser) sticker ut) stärker).
På liknande sätt är Treonine en viktig del av proteiner som tandemalj, elastin och kollagen och har också viktiga funktioner i nervsystemet. Det används som ett kosttillskott och som en "mitigator" av de fysiologiska tillstånden av ångest och depression.
[TOC]
Egenskaper
Treoninen tillhör den polära aminosyragruppen som har en R- eller sidokedjegrupp som saknar positiva eller negativa belastningar (icke -laddade polära aminosyror).
Egenskaperna hos dess R -grupp är gjorda av en mycket löslig aminosyra (hydrofil eller hydrofil), vilket också är sant för de andra medlemmarna i denna grupp, såsom cystein, serin, asparagin och glutamin.
Tillsammans med tryptofan, fenylalanin, isoleucin och tyrosin är Treonine en av de fem aminosyrorna som har både glukogena och ketogena funktioner, för från dess metabolism finns det relevanta mellanhänder som pyruvat och succinyl-CoA.
Denna aminosyran har en ungefärlig molekylvikt av 119 g/mol; Liksom många av aminosyrorna utan belastning har den en isoelektrisk punkt runt 5.87 och dess frekvens i proteinstrukturer är nära 6%.
Vissa författare grupperar Treoninen tillsammans med andra aminosyror med "söt" smak, bland vilka till exempel är serin, glycin och alanin.
Strukturera
A-aminosyror som treonin har en allmän struktur, det vill säga det är vanligt för alla. Detta kännetecknas av närvaron av en kolatom som kallas ”α kol”, som är chiral och till vilken fyra typer av molekyler eller olika substituenter förenas.
Detta kol delar en av sina bindningar med en väteatom, en annan med R -gruppen, som är karakteristisk för varje aminosyra, och de andra två är ockuperade av aminogrupperna (NH2) och karboxyl (COOH), som är vanliga för alla Aminosyrorna.
Toningruppen R har en hydroxylgrupp som gör att den kan bilda vätebroar med andra molekyler i vattenhaltiga medier. Dess identitet kan definieras som en alkoholhaltig grupp (en etanol, med två kolatomer), som har tappat en av sina hydrogener för att gå med i a (-chah-ch3) kolatom.
Denna grupp -OH kan tjäna som en "bro" eller unionsplats för en mängd olika molekyler (detta kan till exempel förenas oligosackarider under bildningen av glykoproteiner) så det är en av de ansvariga för bildandet av bildandet av de modifierade treoninderivaten.
Den biologiskt aktiva formen av denna aminosyran är L-treonin och det är detta som deltar både i bildningen av proteinstrukturer och i de olika metaboliska processerna där den verkar.
Funktioner
Som aminosyraprotein är Treonin en del av strukturen för många proteiner i naturen, där dess betydelse och rikedom beror på identiteten och funktionen protein som det tillhör.
Kan tjäna dig: Heteros: Förbättring av djur, i växter, människaFörutom sina strukturella funktioner i bildningen av peptidsekvensen av proteiner, uppfyller Treonine andra funktioner både i nervsystemet och i levern, där den deltar i metabolismen av fetter och förhindrar dess ackumulering i detta organ i detta organ i detta organ.
Treonine är en del av sekvenserna som känns igen av enzymerna Serre/Treonina -kinaser, som är ansvariga för många proteinfosforyleringsprocesser, väsentliga för reglering av mångfald av funktioner och intracellulära signalhändelser.
Det används också för behandling av vissa tarm- och matsmältningsstörningar och dess användbarhet vid dämpningen av patologiska tillstånd såsom ångest och depression har visats.
L-treonin är också en av de aminosyror som krävs för att upprätthålla det pluripotenta tillståndet för musembryonala stamceller, ett faktum som tydligen är relaterat till metabolismen av S-adenosyl-metionin och med metyleringshändelserna i histoner, som är direkt är direkt involverad i uttrycket av gener.
Inom industrin
En vanlig egenskap för många aminosyror är dess förmåga att reagera med andra kemiska grupper som aldehyder eller ketoner för bildandet av de karakteristiska "smakerna" för många föreningar.
Bland dessa aminosyror är Treonine, som som serin reagerar med sackaros under TOS.
Treonine finns i många läkemedel av naturligt ursprung och även i många formuleringar av näringstillskott som föreskrivs till patienter med undernäring eller som har dåliga dieter i denna aminosyran.
En annan av de mest beryktade funktionerna i L-treonin, och som har ökat över tid, är tillsatsmedel i beredningen av koncentrerad mat för grisar och fjäderfäproduktionindustri.
L-Treonine används i dessa branscher som ett livsmedelstillskott i dåliga formuleringar ur proteinens synvinkel, eftersom detta ger ekonomiska fördelar och lindrar de råa proteinbrister som dessa husdjur konsumerar.
Den huvudsakliga produktionsformen av denna aminosyran är normalt genom mikrobiell jäsning och världsproduktionssiffror för jordbruksändamål för år 2009 överskred 75 ton.
Biosyntes
Treonine är en av de nio essentiella aminosyrorna för människan, vilket innebär att den inte kan syntetiseras av kroppsceller och därför som måste förvärvas från proteiner av djur eller växt ursprung som levereras med den dagliga dieten.
Växter, svampar och bakterier syntetiserar treonin från liknande rutter som kan presentera vissa avvikelser med varandra. De flesta av dessa organismer börjar emellertid från Asparto som föregångare, inte bara för Treonine, utan också för metodin och lysin.
Biosintetisk väg i mikrober
Biosyntesvägen för L-treonin i mikroorganismer såsom bakterier består av fem steg katalyserade av olika enzymer. Avgångsunderlaget är, som kommenterat, aspartatet, som fosforyleras av ett enzym ATP-beroende quinasa-aspartat.
This reaction produces the Metabolite L-asphat phosphate (L-aspartil-p) that serves as a substrate for the semiiadehydic aspartyl enzyme dehydrogenase, which catalyzes its conversion into semi-the-dependent semi-the-dependent aspartyl.
Semiiardhaide aspartyl kan användas både för biosyntes av L-lisin och för biosyntes av L-treonin; I detta fall används molekylen av ett Homoserine-enzym NADPH-beroende beroende för produktion av L-homoserina.
L-homoserinet fosforyleras till L-homoserinfosfat (L-homoserina-P) med ett homoserin-ATP-beroende kinas och nämnda reaktionsprodukt, i sin tur, är ett substrat av syntas-troninenzymet, kapabelt att syntetisera L-trinina.
L-metionin kan syntetiseras från L-homoserin som produceras i föregående steg, så det representerar en "konkurrenskraftig" väg för syntesen av L-treonin.
Den syntetiserade L-treoninen på detta sätt kan användas för proteinsyntes eller kan också användas nedströms för syntes av glycin och L-leucin, två relevanta aminosyror också ur proteinspänningen.
Kan tjäna dig: evolutionära teorierReglering
Det är viktigt att lyfta fram att tre av de fem enzymerna som deltar i biosyntesen av L-treonin i bakterier regleras av produkten av reaktionen genom negativ återkoppling. Dessa är kinasaspartatet, homoserindehydrogenas och homoserinkinas.
Dessutom beror regleringen av denna biosyntetiska väg också på cellkraven för de andra biosyntetiska produkterna relaterade till den, eftersom bildningen av L-l-l-l-l-l-metionin, L-isoleucin och glycin är beroende av produktionsvägen för produktion av produktion av produktion Ljein.
Degradering
Treonin kan försämras med två olika rutter för att producera pyruvat eller succinyl-CoA. Det senare är den viktigaste produkten av treoninkatabolism hos människor.
Treoninmetabolism förekommer främst i levern, men bukspottkörteln, även om det i mindre utsträckning också deltar i denna process. Denna rutt börjar med transport av aminosyran genom plasmamembranet i hepatocyterna med hjälp av specifika transportörer.
Pyruvate -produktion från Treonine
Omvandlingen av treonin till pyruvat sker tack vare dess omvandling till glycin, som äger rum i två katalytiska steg som börjar med bildningen av 2-amino-3-ekotobutirat från troninen och genom verkan av enzymetreonindehydrogenas.
Hos människan representerar denna väg endast mellan 10 och 30% av katabolismen i tronin, men dess betydelse är relativt den organisme som beaktas sedan, till exempel i andra däggdjur, detta är mycket mer relevant kataboliskt prata.
Succinil-CoA-produktion från Treonina
Liksom med Metionine, Valina och Isoleucin används också kolatomerna i Treonin för Succunil-CoA-produktion. Denna process börjar med omvandlingen av aminosyran till a-cetobutirat, som därefter används som ett substrat av a-zo-stoat-dehydrogenasenzymet för att utföra propionil-CoA.
Omvandlingen av treonin till a-cetobutirat katalyseras av enzymdehydrataset, vilket innebär förlust av en vattenmolekyl (H2O) och en annan av en ammoniumjon (NH4+).
Propionyl-CoA är karboxylerad i metylmalonyl-CoA genom en tvåstegsreaktion som kräver inträde av en bikarbonat kolatom (HCO3-). Denna produkt fungerar som ett substrat för ett metylmalonil-CoA-mutasa-koenzym B12-beroende, som "epimeriserar" molekylen för att producera succinyl-CoA.
Andra kataboliska produkter
Dessutom kan kolskelettet av treonin användas kataboliskt för produktion av acetyl-CoA, som också har viktiga konsekvenser från energin i kroppsceller.
I vissa organismer fungerar Treonine också som ett substrat för vissa biosyntetiska rutter som isoleucin, till exempel. I detta fall, genom 5 katalytiska steg, kan a-ecthobutirat härrörande från katabolismen av treonin riktas mot bildningen av isoleucin.
Livsmedel rika på treonin
Även om de flesta av de rikliga livsmedel i protein har en viss procentandel av alla aminosyror, har det fastställts att ägg, mjölk, soja och gelatin är särskilt rika på treoninaminosyran.
Treonine finns också i djurkött som kyckling, gris, kanin, lamm och olika typer av fåglar. I mat av växtens ursprung är det rikligt i choles, på lök, vitlök, chard och aubergine.
Det finns också i ris, majs, vete kli, baljväxter och i många frukter som jordgubbar, bananer, druvor, ananas, plommon och andra nötter som är rika på protein som nötter eller pistascher, bland andra.
Fördelar med ditt intag
Enligt kommittén för experter från Världshälsoorganisationen för jordbruk och mat (som, FAO), är Treoninas dagliga krav för en genomsnittlig vuxen människa cirka 7 mg per kilo kroppsvikt, som måste förvärvas från mat som intas med diet.
Kan tjäna dig: Röd av fenol: egenskaper, förberedelser, applikationerDessa siffror härstammar från experimentella data erhållna från studier utförda med män och kvinnor, där denna mängd treonin är tillräcklig för att få en positiv kvävebalans i kroppsceller.
Studier med barn mellan 6 månader och ett år har emellertid visat att för dessa är minimikraven för L-treonin mellan 50 och 60 mg per kilo vikt per dag.
Bland de viktigaste fördelarna med intaget av näringstillskott eller läkemedel med speciella formuleringar rika på L-treonin är behandlingen av lateral amyotrofisk skleros eller Lou Gehrig-sjukdom.
Ytterligare treoninförsörjning gynnar absorptionen av näringsämnen i tarmen och bidrar också till förbättringen av leverfunktioner. Det är också viktigt för transport av fosfatgrupper genom celler.
Brist
Hos små barn föds defekter i Treonine Metabolism som orsakar tillväxtfördröjning och andra relaterade metaboliska störningar.
Brister i denna aminosyra har förknippats med vissa misslyckanden i barnviktökning, utöver andra patologier relaterade till bristen på kvävehållning och dess förlust i urin.
Människor som utsätts för dåliga dieter i Treonina kan ha en större benägenhet att drabbas av fet lever och vissa tarminfektioner relaterade till denna aminosyr.
Referenser
- Barret, g., & Elmore, D. (2004). Aminosyror och peptider. Cambridge: Cambridge University Press.
- Borgonha, s., Regan, m. M., Oh s. H., Condon, m., & Young, V. R. (2002). Treoninbehov för friska vuxna, derced med 24-timmars indikator amininosyrbalanssteknik. American Journal of Clinical Nutrition, 75(4), 698-704.
- Bradford, h. (1931). Historien om upptäckten av aminosyrorna. Ii. En översyn av aminosyror som beskrivs sedan 1931 som komponenter i nativa proteiner. Framsteg inom proteinkemi, 81-171.
- Champe, s., & Harvey, r. (2003). Aminosyror aminosyror. I Lippincott's Illustrated Reviews: Biochemistry (3: e upplagan., pp. 1-12). Lippincott.
- De lange, c. F. M., Gillis, a. M., & Simpson, g. J. (2001). Påverkan av treoninintaget på whoe-kroppsproteinavlagring och treonin usation i växande grisar som matas renade dieter. Journal of Animal Science, 79, 3087-3095.
- Edelman, a., BLUMENTHAL, D., & Krebs, och. (1987). Serinkinasprotein. Annu. Varv., 56, 567-613.
- Edsall, J. (1960). Aminosyror, proteiner och cancerbiokemi (Vol. 241). London: Academic Press, Inc.
- Hus, j. D., Hall, b. N., & Brosnan, J. T. (2001). Treoninmetabolism hos isolerade råtthepatocyter. American Journal of Physiology - Endocrinology and Metabolism, 281, 1300-1307.
- Hudson, b. (1992). Biokemi av livsmedelsproteiner. Springer-Science+Business Media, f.V.
- Kaplan, m., & Flavin, m. (1965). Treoninbiosyntes. På vägen i svampar och bakterier och mekanismen för isomeriseringsreaktionen. Journal of Biologic Chemistry, 240(10), 3928-3933.
- Kidd, m., & Kerr, f. (nitton nittiosex). L-Threonine for Poultry: A Review. Applied Poultry Science, Inc., 358-367.
- Pratt, E., Snyderman, s., Cheung, m., Norton, s., & Holt, och. (1954). Det normala spädbarnets treoninbehov. Journal of Nutrition, 10(56), 231-251.
- Rigo, j., & Senterre, J. (1980). Optimalt treinintag för för tidigt infatering som matas på oral eller parenteral näring. Journal of Parenteral and Enteral Nutrition, 4(1), 15-17.
- Shyh-chang, n., Locasale, j. W., Lyssiotis, c. TILL., Zheng och., Teo, r. OCH., Ratanasirintrawoot, s.,... Cantley, L. C. (2013). Påverkan av treoninmetabolism på S-adenensylmetionin och histonmetylering. Vetenskap, 339, 222-226.
- Vickery, h. B., & Schmidt, c. L. TILL. (1931). Historien om upptäckten av aminosyrorna. Kemiska recensioner, 9(2), 169-318.
- MD -webb. (n.d.). Hämtad 10 september 2019 från www.WebMD.com/vitaminer/AI/ingrediensmono-1083/treonin
- Wormser, E. H., & Pardee, till. B. (1958). Reglering av treoninbiosyntes i Escherichia coli. Arkiv för biokemi och biofysik, 78(2), 416-432.
- Xunyan, x., Quinn, s., & Xiaoyuan, x. (2012). Forskningsport. Hämtad 10 september 2019 från www.Forskning.net/figur/biosyntes-pathway-of-l-treonine-the-pathway-consists-of-fi-ve-enzymmatic-stegen_fig1_232320671

