Tin Oxide (II) Struktur, egenskaper, nomenklatur, användningar

- 1805
- 142
- Lars Eriksson
han Tennoxid (II) Det är ett kristallint oorganiskt fast ämne som bildas genom oxidation av tenn (SN) av syre, där tenn förvärvar Valencia 2+. Dess kemiska formel är SNO. Två olika sätt för denna förening är kända: det svarta och det röda. Den vanliga och mest stabila formen vid rumstemperatur är svart eller svartblå modifiering.
Denna form framställs genom tennkloridhydrolys (II) (SNCL2) I vattenlösning, till vilken ammoniumhydroxid tillsätts (NH4OH) för att få en hydratiserad oxidutfällning från SN (II) vars formel är SNO.Xh2Eller där x<1 (x menor que 1).
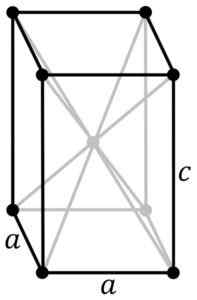 Tetragonal kristallin struktur av den svarta blå snoen. SN -atomen är belägen i mitten av strukturen och syreatomerna i topparna av parallellepiped. Original PNGS av användare: Rocha, spårad i Inkscape av användare: Stannered [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]] Källa: Wikipedia Commons
Tetragonal kristallin struktur av den svarta blå snoen. SN -atomen är belägen i mitten av strukturen och syreatomerna i topparna av parallellepiped. Original PNGS av användare: Rocha, spårad i Inkscape av användare: Stannered [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]] Källa: Wikipedia Commons Hydratiserad oxid är ett vitt amorft fast ämne, som sedan upphettas i suspension till 60-70 ºC under flera timmar i närvaro av NH4Åh, tills du får den svarta kristallina rena SNO.
SNO: s röda form är metastabla. Det kan framställas genom att tillsätta fosforsyra (h3Po4) - med 22% fosforsyra, h3Po3 - Och sedan NH4Åh en SNCL -lösning2. Det vita fasta ämnet upphettas i samma lösning till 90-100 ºC i cirka 10 minuter. På detta sätt erhålls den rena röda kristallina SNO.
Tennoxid (ii) är ett utgångsmaterial för produktion av andra tennföreningar (ii). Av denna anledning är det en av tennföreningarna som har en märkbar kommersiell betydelse.
Tennoxid (ii) presenterar låg toxicitet som med de flesta tennorganiska föreningar. Detta beror på deras dåliga absorption och snabb utsöndring av levande varelser.
Det kan tjäna dig: bipe beraral: vad är, egenskaper, vad är det förPresenterar en av de största toleranserna för tennföreningar i tester som utförs med råttor. Det kan dock vara skadligt om det inhaleras i stora mängder.
[TOC]
Strukturera
Tennoxid (ii) svartblå
Denna modifiering kristalliseras med tetragonal struktur. Det har ett lager ordna.
Andra forskare bekräftar att varje SN -atom är omgiven av 5 syreatomer som finns ungefär i vertikalerna i en oktaedron, där den sjätte toppunkten antagligen ockuperas av ett par fria eller inte parade elektroner. Detta är känt som det φ-oktiska arrangemanget.
Röd tennoxid (ii)
Denna form av tennoxid (ii) kristalliseras med ortorrombisk struktur.
Nomenklatur
- Tennoxid (II)
- Estanyoxid
- Tennmonoxid
- Estanyoxid
Egenskaper
Fysiskt tillstånd
Kristallt fast.
Molekylvikt
134,71 g/mol.
Smältpunkt
1080 ºC. Det sönderdelas.
Densitet
6.45 g/cm3
Löslighet
Olöslig i kallt eller varmt vatten. Olöslig i metanol, men det löses snabbt i syror och koncentrerade alkalier.
Andra egenskaper
Om mer än 300 ºC värms upp i närvaro av luft, oxideras tennoxiden (ii) snabbt i tennoxid (iv) som presenterar glödmask.
Det har rapporterats att under icke-oxidantförhållanden har tennoxid (ii) uppvärmning olika resultat enligt graden av renhet av startoxiden. Det är i allmänhet oproportionerligt i metallisk SN och tennoxid (iv), SNO2, Med olika mellanarter som äntligen blir SNO2.
Tennoxid (ii) är amfoto, eftersom den är upplöst i syror för att ge SN -joner2+ eller anjonkomplex, och upplöses också i Alkalis för att bilda hydroxi-stanning-jonlösningar, SN (OH)3-, som har en pyramidstruktur.
Det kan tjäna dig: perklorsyra: formel, egenskaper och användningarDessutom är SNO ett reducerande medel och reagerar snabbt med organiska syror och mineraler.
Det presenterar låg toxicitet om det jämförs med andra tennsalter. Dess DL50 (50% dödlig dos eller medium dödlig dos) hos råttor är mer än 10000 mg/kg. Detta innebär att mer än 10 gram per kilo krävs för att döda 50% av råttproverna under en viss provperiod. Som jämförelse presenterar tennfluorid (ii) en 188 mg/kg dl50.
Men om den inandas länge, avsätts den i lungorna eftersom den inte absorberas och kan producera tenn (infiltration av SNO -dammet i lungintervikarna).
Ansökningar
Vid produktion av andra tennföreningar (ii)
Dess snabba reaktion med syror är grunden för dess viktigaste användning, som är som en mellanhand i tillverkningen av andra tennföreningar.
Det används vid produktion av tennbromid (II) (SNBR2), Tenncyanid (II) (SN (CN)2) och tennfluoroborathydrat (II) (SN (BF4)2), Bland andra tennföreningar (ii).
Tin FluorBorate (II) framställs genom att lösa snam. Detta beror bland annat på dess höga täckningskapacitet.
Tin (ii) Oxid används också i tennsulfatberedning (ii) (SNSO4), genom SNO och svavelsyrareaktion, h2Sw4.
SNSO4 Erhålls, den används i den konserverade processen för produktion av tryckta kretsplattor, för den elektriska kontaktfinishen och för köksredskap.
Kan tjäna dig: aluminiumkarbonat: struktur, egenskaper, användningar Tryckt krets. Ingen maskinläsbar författare tillhandahållen. Abraham del Pozo antog (baserat på upphovsrättsanspråk). [Public Domain] Källa: Wikimedia Commons
Tryckt krets. Ingen maskinläsbar författare tillhandahållen. Abraham del Pozo antog (baserat på upphovsrättsanspråk). [Public Domain] Källa: Wikimedia Commons SNO: s hydratiserade form, tennhydrotado (ii) SNO.Xh2Eller, den behandlas med fluorhorhorinsyra för att erhålla tennfluorid (ii), SNF2, som läggs till tandkrämer som agent för att bekämpa karies.
I smycken
Tennoxid (ii) används vid framställning av guldsträckning och kopparstubbar kristaller. Uppenbarligen är dess funktion i denna applikation att fungera som ett reducerande agent.
 Juvel med Ruby. Källa: Pixabay
Juvel med Ruby. Källa: Pixabay Andra användningsområden
Det har använts i fotovoltaiska enheter för produktion av el från ljus, såsom solceller.
 Fotovoltaisk enhet. Georg Slickers [CC BY-SA 2.5 (https: // CreativeCommons.Org/licenser/BY-SA/2.5)] Källa: Wikipedia Commons
Fotovoltaisk enhet. Georg Slickers [CC BY-SA 2.5 (https: // CreativeCommons.Org/licenser/BY-SA/2.5)] Källa: Wikipedia Commons Nya innovationer
SNO-ordnade nanopartiklar har använts i kolananorör elektroder för litiumsockerbatterier.
 SNO -hydrat nanofibrer. Fionán [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Källa: Wikipedia Commons
SNO -hydrat nanofibrer. Fionán [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Källa: Wikipedia Commons SNO -beredda elektroder uppvisar hög konduktivitet och liten förändring i volym i repetitiva belastningar och nedladdningscykler.
Dessutom underlättar SNO en snabb jon/elektronöverföring under oxidationsreduktionsreaktioner som förekommer i sådant batterisystem.
Referenser
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Dans, j.C.; Emeléus, h.J.; Sir Ronald Nyholm och Trotman-Deckenson, till.F. (1973). Omfattande oorganisk kemi. Volym 2. Pergamonpress.
- Ullmanns Encyclopedia of Industrial Chemistry. (1990). Femte upplagan. Volym A27. VCH Verlagsgellschaft MBH.
- Kirk-THERMER (1994). Encyclopedia of Chemical Technology. Volym 24. Fjärde upplagan. John Wiley & Sons.
- Ostrakhovitch, elena till. Och Cherian, m. George. (2007). Tenn. I Handbook of the Toxicology of Metals. Tredje upplagan. Återhämtat sig från Scientedirect.com.
- Kwestroo, W. och Vromans, s.H.G.M. (1967). Beredning av tre modifieringar av ren tenn (II) oxid. J. Inorg. Nukle. Kem., 1967, Vol.29, sid.2187-2190.
- Foud, s.S et al. (1992). Optiska egenskaper hos tunna filmer. Tjeckoslovakiska tidskriften för fysik. Februari 1992, volym 42, nummer 2. Återhämtat sig från Springer.com.
- A-Young Kim et al. (2017). Beställde SNO-nanopartiklar i MWCNT som ett funktionellt värdmaterial för höghastighetslitium-svavel-batterikatod. Nano Research 2017, 10 (6). Återhämtat sig från Springer.com.
- National Library of Medicine. (2019). Gynnsam oxid. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- « Jacquard vävstolshistoria, drift, användningar
- Funktionalism (arkitektur) historia, egenskaper, fungerar »

