Kaliumjodid (ki) struktur, egenskaper, erhållning, användningar, risker

- 4789
- 1171
- Erik Eriksson
han kaliumjodid Det är en oorganisk förening bildad av en kaliumjon (K+) och en jodidjon (i-). Dess kemiska formel är ki. Det är ett vitt kristallint fast ämne, av jonisk natur och är mycket löslig i vatten.
KI tillåter flera kemiska reaktioner och analyser och används för att mäta mängden ozon i atmosfären. Det används också i infraröd analysutrustning (IR).
 Fast ki kaliumjodid. Ondřej Mangl [Public Domain]. Källa: Wikimedia Commons.
Fast ki kaliumjodid. Ondřej Mangl [Public Domain]. Källa: Wikimedia Commons. Kaliumjodid tillsätts till det gemensamma bordsaltet för att förhindra en jodbrist hos människor, eftersom detta kan utgöra ett allvarligt hälsoproblem.
Det används som en slemlösande eftersom det hjälper att slem kan flyta enkelt från andningskanaler utanför. Det tjänar också till att behandla vissa svampinfektioner och används i vissa kosmetika.
Det används av veterinärläkare för att bota djur av problem som liknar människor, såsom hosta och hudinfektioner. Det läggs till och med till i mycket små mängder till djur för djur.
[TOC]
Strukturera
Kaliumjodid är en jonisk förening bildad av kaliumkatjonen K+ Och Yoduro I -anjonen-, Därför är länken mellan dem joniska. Kaliumoxidationsstatusen är +1 och Valencia del jod är -1.
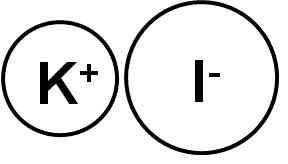 Kaliumjodid är en jonisk förening. Författare: Marilú Stea.
Kaliumjodid är en jonisk förening. Författare: Marilú Stea. Ki kaliumjodidkristaller är kubiska.
 Struktur av en ki kaliumjodid. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons.
Struktur av en ki kaliumjodid. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons. Nomenklatur
- Kaliumjodid
- Kaliumjodid
Egenskaper
Fysiskt tillstånd
Kristallint vitt fast ämne. Kubikkristaller.
Molekylvikt
166,003 g/mol
Smältpunkt
681 ºC
Kokpunkt
1323 ºC
Densitet
3,13 g/cm3
Löslighet
Mycket lösligt i vatten: 149 g/100 g vatten vid 25 ° C. Något lösligt i etanol och eter.
Kan tjäna dig: neon: historia, egenskaper, struktur, risker, användningarpH
Dess vattenhaltiga lösningar är neutrala eller alkaliska, med pH mellan 7 och 9.
Kemiska egenskaper
Något hygroskopisk i fuktig luft.
Det är stabilt i torr luft. Ljus och fuktighet påskyndar dess sönderdelning och dess färg förändras till gult på grund av frisläppandet av små mängder jod (i2) och yodatos (io3-).
Ki vattenhaltiga lösningar blir också gula över tiden, men med lite alkali kan detta undvikas.
Dessa lösningar löses upp till jod (i2) Ge ki3:
Yo- + Yo2 → i3-
Andra egenskaper
Den har en starkt bitter och saltlösning. Det är inte brandfarligt.
Erhållande
Kaliumjodid kan erhållas genom att värma jod (i2) I en koncentrerad lösning av kaliumhydroxid (KOH):
3 i2 + 6 koh → 5 ki + kio3 + H2ANTINGEN
Den resulterande yodato- och jodidlösningen värms upp för att eliminera vatten, den reduceras till torrhet, kol tillsätts och upphettas vid hög temperatur. Kol tar syre från jodat och oxiderar koldioxid och reducerar jodid till jodid:
2 kio3 + C → 2 ki + 3 co2
Kaliumjodid som erhålls kan omkrypteras för att rena den. Det vill säga det återupptäcks i vatten och inducerar att kristallisera igen.
Ansökningar
Vid behandling av hypertyreoidism
Kaliumjodid fungerar som ytterligare behandling tillsammans med andra antityreosmedel för att behandla hypertyreos.
Hypertyreoidism är en sjukdom som får sköldkörteln att producera för mycket sköldkörtelhormon, med ökad sköldkörtelstorlek, minskad vikt av personen, accelererad hjärtslag och irritabilitet, bland andra symtom.
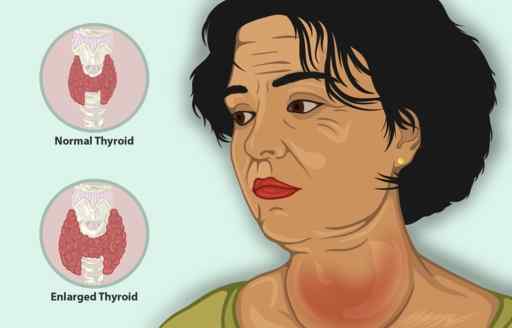 Kvinna med inflammerad sköldkörtel. Det kan behandlas med ki kaliumjodid. https: // www.Myupchar.com/i [cc by-sa (https: // creativecommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons.
Kvinna med inflammerad sköldkörtel. Det kan behandlas med ki kaliumjodid. https: // www.Myupchar.com/i [cc by-sa (https: // creativecommons.Org/licenser/BY-SA/4.0)]. Källa: Wikimedia Commons. Hos patienter med hypertyreos minskar KI snabbt symtom eftersom det hämmar frisättningen av sköldkörtelhormon.
Dess sköldkörteleffekter är: minskade mängden blodkärl i körtlarna, bekräftelse av deras vävnader och minskade storleken på deras celler.
Av denna anledning gäller det som en preoperativ behandling för att inducera involvering eller minskning av sköldkörtelstorleken före sköldkörtelektomi (avlägsnande av sköldkörteln) eftersom denna operation underlättas.
Kan tjäna dig: natrium: historia, struktur, egenskaper, risker och användningarI andra medicinska tillämpningar
Kaliumjodid har släckta egenskaper när utsöndring av andningsvätskor ökar, vilket resulterar i minskad slemviskositet.
 Kaliumjodid kan fungera som en släckt medel vid hostabehandling. Författare: анастiful геп. Källa: Pixabay.
Kaliumjodid kan fungera som en släckt medel vid hostabehandling. Författare: анастiful геп. Källa: Pixabay. Det tjänar för behandling av Nodoso erytem, vilket är en smärtsam inflammation i benen där röda knölar och ökad temperatur bildas.
Är en antihongos agent. Det gör det möjligt att behandla sporotros som är en hudinfektion orsakad av en svamp. Denna sjukdom händer med människor som arbetar med växter och mark, till exempel jordbrukare och trädgårdsmästare.
Det används också vid behandling av jodbrist eller för att undvika den och lägg därför till bordssaltet eller ätbart salt (natriumklorid NaCl) som en källa till jod och ibland i vatten att dricka.
I veterinärapplikationer
Kaliumjodid administreras till djur som antitustivt, för att öka och kondensera luftvägarna, för bronkial kronisk hosta, liksom i fall av reumatism och som en anti -inflammatorisk.
Det tjänar också för mykos (svampinfektioner) av djur, för att minska klåda och för kronisk bly eller kvicksilverförgiftning.
Vid skyddet av sköldkörteln i radioaktiva nödsituationer
Kaliumjodid har sköldkörtelskyddande egenskaper i händelse av att personen har utsatts för kärnkraftstrålning.
KI översvämmar sköldkörteln med icke -radioaktiv jod och blockerar därmed att ta radioaktiva molekyler och absorption av radioaktiv jod, och skyddar sköldkörteln från cancer som kan orsaka strålning.
I ozonmått i atmosfären
Ozongas (eller3) Det kan mätas i atmosfären med hjälp av elektrolytiska celler som kallas ozonosandor, som transporteras av radiodiosondas ballonger.
Kan tjäna dig: Benchilo BenzoateDessa elektrolytiska celler innehåller en Ki -kaliumjodidlösning. Cellerna är initialt i kemisk och elektrisk balans.
När ett luftprov med ozon (eller3) Penetrerar en av cellerna Balansen är trasig eftersom följande reaktion inträffar:
2 ki + eller3 + H2O → i2 + ANTINGEN2 + 2 koh
Denna reaktion ger en elektrisk ström som flyter mellan celler.
Mängden elektrisk ström som produceras överförs kontinuerligt av radiovågor till en station på land. På detta sätt erhålls ozonprofilen som är från marken till bollens höjd.
 Ballong ta av med radiosonda med ki för att mäta ozon. Hannes Grobe 19:27, 20 juni 2007 (UTC), Alfred Wegener Institute for Polar and Marine Research, Bremerhaven, Tyskland [CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/2.5)]]. Källa: Wikimedia Commons.
Ballong ta av med radiosonda med ki för att mäta ozon. Hannes Grobe 19:27, 20 juni 2007 (UTC), Alfred Wegener Institute for Polar and Marine Research, Bremerhaven, Tyskland [CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/2.5)]]. Källa: Wikimedia Commons. I flera användningsområden
Kaliumjodid tillåter också:
- Eliminering av fria radikaler som hydroxylradikal OH.
- Tillverkning av fotografiska emulsioner, för att fälla ut silver.
- Förbättra djurfoder när det läggs till i mikrokontor.
- Deodorisera nötkreatur.
- Överföra det infraröda spektrumljuset i IR -analysutrustning.
- Utför vissa kemiska reaktioner och analys i kemilaboratorier.
- Använd det i personliga hygienprodukter.
- Utför miljöföroreningsanalys.
Risker
Vissa människor är känsliga för jodid.
Personer med tuberkulos eller akut bronkit bör också vara försiktiga.
KI kan orsaka mjukning av salivkörtlarna, det kan bränna munnen eller halsen, en ovanlig ökning av saliv, tandvärk och inflammation i tandköttet och metallsmak, bland andra symtom.
Du kan också irritera ögonen och öppna sår på huden.
Referenser
- ELLER.S. National Library of Medicine. (2019). Kaliumjodid. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Kirk-THERMER (1994). Encyclopedia of Chemical Technology. Fjärde upplagan. John Wiley & Sons.
- Dean, J.TILL. (redaktör). (1973). Langes handbok för kemi. Elementh Edition. McGraw-Hill Book Company.
- Valkovic, V. (2019). Dekontaminering efter strålningsexponering. Mest känsliga kroppsdelar. I radioaktivitet i miljön (andra upplagan). Återhämtat sig från Scientedirect.com.
- Smit, h.G.J. (2015). Kemi för atmosfären-observationer för kemi (in situ). I Encyclopedia of Atmospheric Sciences (andra upplagan). Återhämtat sig från Scientedirect.com.
- Muralikrishna, jag.V. och Manickam, V. (2017). Analytiska metoder för övervakning av miljöföroreningar. I miljöledning. Återhämtat sig från Scientedirect.com.
- Wallace, J.M. och Hobbs, s.V. (2006). Atmosfärisk kemi 1. I Atmospheric Science (andra upplagan). Återhämtat sig från Scientedirect.com.
- « Förändringar av tillståndstyper och deras egenskaper (med exempel)
- Dekanteringskoncept, exempel och typer »

