50 exempel på syror och baser

- 1719
- 55
- Johan Eriksson
Det finns hundratals Exempel på syror och baser Det finns i alla grenar av kemi, men att de som helhet är uppdelade i två stora familjer: oorganiska och organiska. Oorganiska syror kallas vanligtvis mineralsyror, kännetecknas av att vara särskilt starka jämfört med organiska.
Syror och baser förstås som ämnen som har jordiska smaker respektive saponáceos. Båda är frätande, även om ordet "kaustiskt" vanligtvis används för starka baser. Sammanfattningsvis konton: de förbränner och kör huden om de rör vid den. Dess egenskaper i lösningsmedium har planerat en serie definitioner genom historien.
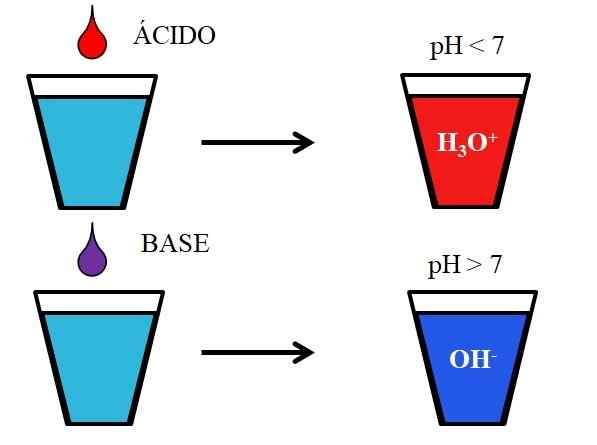 Beteende hos syror och baser när det är upplöst i vatten. Källa: Gabriel Bolívar.
Beteende hos syror och baser när det är upplöst i vatten. Källa: Gabriel Bolívar. Den nedre bilden visar det generiska beteendet hos syror och baser när de tillsätts eller upplöstes i ett glas med vatten. Syror producerar lösningar med pH -värden under 7 på grund av hydroniojoner, h3ANTINGEN+; Medan baserna producerar lösningar med pH över 7 på grund av hydroxyljoner (eller oxydril), OH-.
Om vi lägger till saltsyra, HCl (röd droppe), till glaset kommer det att finnas H -joner3ANTINGEN+ och cl- hydratiserad. Å andra sidan, om vi upprepar experimentet med natriumhydroxid, NaOH (lila droppe), kommer vi att ha OH -joner- och na+.
[TOC]
Definitioner

Egenskaperna, alltmer studerade och förstås, av syror och baser sätter mer än en definition för dessa kemiska föreningar. Bland dessa definitioner har vi den av Arrhenius, det av bronsted-LOWRY, och slutligen Lewis. Innan du citerar exemplen är det nödvändigt att ha detta klart.
Arrhenius
Syror och baser, enligt Arrhenius, är de som upplöstes i vatten producerar hjoner3ANTINGEN+ eller åh-, respektive. Det vill säga bilden representerar redan denna definition. Men i sig föraktar det vissa för svaga syror eller baser för att producera sådana joner. Det är här definitionen av Bronsted-Lowry kommer in.
Kan tjäna dig: syror: egenskaper och exempelBronst-liv
Bronsted-lowry syror är de som kan donera joner h+, Och baserna är de som accepterar dessa h+. Om en syra donerar mycket lätt+, Det betyder att det är en stark syra. Detsamma gäller för baserna, men accepterar h+.
Således har vi starka eller svaga syror och baser, och deras krafter mäts i olika lösningsmedel; särskilt i vattnet, av vilka de kända pH -enheterna är etablerade (från 0 till 14).
Därför kommer en stark syra fullständigt att donera sin h+ till vattnet i en reaktion av typen:
Ha + h2O => a- + H3ANTINGEN+
Vart man ska- Det är den konjugerade basen för HA. Härifrån kommer därför h3ANTINGEN+ närvarande i glaset med syralösning.
Samtidigt kommer en svag B -bas att oskyddade vattnet för att få sin respektive h+:
B + h2Eller HB + OH-
Där Hb är den konjugerade syran i B. Detta är fallet med ammoniak, NH3:
Nh3 + H2Eller NH4+ + Åh-
En mycket stark bas kan direkt donera OH -joner- Inget behov av att reagera med vatten; Som med NaOH.
Lewis
Slutligen är Lewis -syror de som vinner eller accepterar elektroner, och Lewis baser är de som donerar eller förlorar elektroner.
Till exempel Bronsted-Lowry NH-basen3 Det är också en Lewis -bas, eftersom kväveatomen accepterar en h+ Genom att donera detta deras par gratis elektroner (h3N: h+). Det är därför de tre definitionerna inte håller med varandra, men de sammanflätas och hjälper till att studera surhet och basicitet i ett bredare spektrum av kemiska föreningar.
Kan tjäna dig: nickel: historia, egenskaper, struktur, användningar, riskerExempel på syror
Efter att ha klargjort definitionerna kommer en serie syror att nämnas nedan med sina respektive formler och namn:
-HF: fluorhydronsyra
-HBR: Bromhydric Acid
-Hej: Yodhydrric Acid
-H2S: sulfhydronsyra
-H2SE: Seleenhydronsyra
-H2TE: telurhydrionsyra
Dessa är binära syror, även kallade hydraceider, som tillhör den ovannämnda saltsyran, HCl.
-Hno3: salpetersyra
-Hno2: Kvävesyra
-HNO: hyponitroinsyra
-H2Co3: Kolsyra
-H2Co2: karbonososyra, som faktiskt är mer känd med namnet på myrsyra, HCOOH, den enklaste organiska syran av alla
-H3Po4: fosforsyra
-H3Po3 eller h2[HPO3]: fosforsyra, med en H-P-bindning
-H3Po2 eller h [h2Po2]: Hypofosfärsyra, med två H-P-bindningar
-H2Sw4: svavelsyra
-H2Sw3: Svavelsyra
-H2S2ANTINGEN7: disulfurinsyra
-Hio4: periódinsyra
-Hio3: Yodiumsyra
-Hio2: jodosyra
-Hio: Hypoyodososyra
-H2Cro4: krominsyra
-Hmno4: Mangansyra
-Ch3COOH: ättiksyra (vinäger)
-Ch3Sw3H: Metanosulfonsyra
Alla dessa syror, med undantag för de formella och de två sista, är kända som Oxácidos eller ternarsyror.
Andra:
-Alcl3: aluminiumklorid
-Fecl3: järnklorid
-Bf3: Boro Trifluoruro
-Metallkatjoner upplöstes i vatten
-Kargort
-H (chbelvaKlielva): Super Acid Carborano
- Fso3H: Fluorosulfonsyra
- Hsbf6: Fluoroantimonsyra
- Fso3H · sbf5: Magisk syra
De sista fyra exemplen utgör de fruktansvärda supersyrorna; föreningar som kan sönderdelas nästan allt material med knappt vidröra det. Alcl3 Det är ett exempel på Lewis Acid, eftersom aluminiummetallcentret kan acceptera elektroner på grund av dess elektroniska brist (den slutför inte sin Valencia -oktett).
Kan tjäna dig: kvicksilverhydroxid: struktur, egenskaper, användningar, riskerExempel på baser
Bland de oorganiska baserna har vi metallhydroxider, såsom natriumhydroxid, och några molekylära hydurns, såsom ammoniak som redan citeras. Här är andra exempel på baser:
-KOH: Kaliumhydroxid
-LIOH: litiumhydroxid
-RBOH: Rubidio Hydroxide
-CSOH: Cesiumhydroxid
-FROH: Francio Hydroxide
-Vara (oh)2: Berylhydroxid
-Mg (OH)2: magnesiumhydroxid
-Ca (oh)2: kalcium hydroxid
-SR (OH)2: Strontiumhydroxid
-BA (OH)2: bariumhydroxid
-RA (OH)2: radiohydroxid
-Tro (OH)2: järnhydroxid
-Tro (OH)3: järnhydroxid
-Al (OH)3: aluminiumhydroxid
-PB (OH)4: Plúmbic hydroxid
-Zn (OH)2: zinkhydroxid
-CD (OH)2: kadmiumhydroxid
-CU (OH)2: Cupric hydroxid
-Ti (oh)4: Titanic Hydroxide
-PH3: fosfin
-Aska3: Arsina
-Nanh2: natrium amiduro
- C5H5N: pyridin
-(Ch3) N: Trimetylamin
- C6H5Nh2: Fenylamin eller anilin
-NAH: natriumhydrid
-KH: Kaliumhydrid
-Karbanioner
-Li3N: litiumnitrid
-Alkoxider
-[(Ch3)2Ch]2NLI: Diisopropilamid av litium
-Dietinilbenzene anjon: c6H4C42- (den starkaste basen som hittills är känd)
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Naomi Hennah. (10 oktober 2018). Hur man undervisar syror, baser och salter. Återhämtat sig från: edu.Rsc.org
- Helmestine, Anne Marie, PH.D. (31 augusti 2019). Formler av vanliga syror och baser. Återhämtat sig från: tankco.com
- David Wood. (2019). Jämför vanliga syror och baser. Studie. Återhämtat sig från: studie.com
- Ross pomeroy. (23 augusti 2013). Världens starkaste syror: som eld och is. Återhämtat sig från: RealClearscience.com
- Wikipedia. (2019). Dietylbenzendianion. Hämtad från: i.Wikipedia.org
- « Diameter symboler och formler, hur man tar ut det, omkrets
- Ekofysiologi vad studier och tillämpningar på djur och grönsaker »

