Absorbans Vad är, exempel och övningar löst
- 4745
- 808
- Per Karlsson
De absorbans Det är logaritmen med ett negativt tecken på kvoten mellan den framväxande ljusintensiteten och den lätta incidentintensiteten på ett prov av genomskinlig lösning som har upplystes med monokromatiskt ljus. Denna kvot är överföring.
Den fysiska processen för ljuspassage genom ett prov kallas lysande överföring, Och absorbans är ett mått på det. Därför blir absorbans den minsta logaritmen för transmittans och är ett viktigt faktum för att bestämma koncentrationen av ett prov som i allmänhet löses i ett lösningsmedel såsom vatten, alkohol eller någon annan.
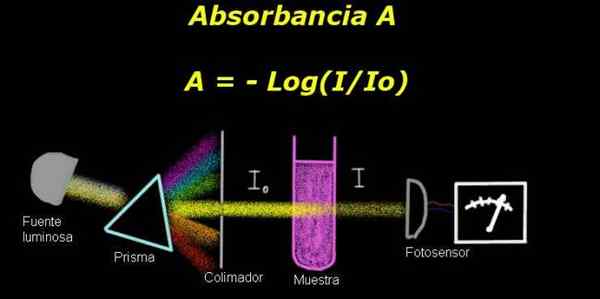
 Figur 1. Schemat för absorbansprocessen. Förberedd av f. Zapata
Figur 1. Schemat för absorbansprocessen. Förberedd av f. Zapata För att mäta absorbans krävs en enhet Elektrofotometer, med vilken en ström mäts som är proportionell mot den lysande intensitetshändelsen på ytan.
Vid beräkning av överföringen mäts vanligtvis signalen om intensiteten som motsvarar lösningsmedlet ensam och detta resultat registreras som Io.
Sedan löstes provet i lösningsmedlet med samma belysningsförhållanden placeras. Åtgärden mätt med elektrofotometern betecknas som Yo, vilket gör att du kan beräkna överföring T Enligt följande formel:
T = i / iantingen
Det är en utlöst kvantitet. De Absorbans a Detta uttrycks som:
A = - log (t) = - log (i / iantingen)
[TOC]
Molar absorbans och absorbering
Molekylerna som utgör en kemikalie kan absorbera ljus, och ett mått på detta är exakt absorbans. Det är resultatet av interaktionen mellan fotoner och molekylära elektroner.
Därför är det en storlek som kommer att bero på densitet eller koncentration av molekylerna som utgör provet och även av den optiska vägen eller avståndet som körs av ljuset.
Du kan tjäna dig: Newtons tredje lag: applikationer, experiment och övningarExperimentella data indikerar att absorbans TILL är linjärt proportionell mot koncentration C och distans d Ljus reste. Så för att beräkna det baserat på dessa parametrar kan följande formel fastställas:
A = ε⋅C⋅D
I den föregående formeln, ε Det är en konstant av proportionalitet känd med namnet Molar absorberande.
Molär absorbitet beror på vilken typ av substans och våglängd som absorbansen mäts. De Molar absorberande Det är också känsligt för provets temperatur och pH för samma.
Öl-lambertlag
Detta samband mellan absorbans, absorbitet, koncentration och avstånd från tjockleken på vägen som ljuset följer inom provet kallas öl-lambertlag.
 figur 2. Öllag - Lambert. Källa: f. Zapata,
figur 2. Öllag - Lambert. Källa: f. Zapata, Nedan finns några exempel på hur man använder det.
Exempel
Exempel 1
Under ett experiment med ett prov med ett rött ljus av en helium-neon-laserbelysning, vars våglängd är 633 nm. En elektrofotometer mäter 30 mV när laserljus påverkar direkt och 10 mV när den passerar genom ett prov.
I detta fall är överföringen:
T = I / IO = 10 mV / 30 mV = ⅓.
Och absorbansen är:
A = - log (⅓) = log (3) = 0,48
Exempel 2
Om samma ämne placeras i behållare som har halva det tjocka.
Det måste beaktas att om tjockleken minskar till hälften, så minskar absorbansen som är proportionell mot den optiska tjockleken med hälften, det vill säga A = 0,28. Massöverföring kommer att ges av följande förhållande:
Kan tjäna dig: vertikalt skott: formler, ekvationer, exempelT = 10-a = 10^(-0.28) = 0,53
Elektrofotometern markerar 0,53*30 mV = 15,74 mV.
Löst övningar
Övning 1
Det är ville bestämma den molära absorbiteten hos en viss patenterad förening som är i lösning. För detta är lösningen med ljus från en 589 nm natriumlampa upplyst. Provet kommer att placeras på en 1,50 cm tjock.
Det är baserat på en koncentrationslösning 4,00 × 10^-4 mol per liter och transmittansen mäts vilket resulterar i 0,06. Bestäm med dessa data molens molära absorbitet.
Lösning
För det första bestäms absorbansen, som definieras som den minst logaritmbaserade tio av transmittans:
A = - log (t)
A = - log (0,06) = 1,22
Sedan används lagen om Lambert-Beer som skapar ett samband mellan absorbans, molär absorbering, koncentration och optisk längd:
A = ε⋅C⋅D
Renering av den molära absorbiteten Följande relation erhålls:
ε = a/(c⋅d)
ersätta de givna värdena:
ε = 1,22/(4,00 × 10^-4 m⋅1,5 cm) = 2030 (M⋅CM)^-1
Det föregående resultatet har avrundats till tre betydande siffror.
Övning 2
För att förbättra noggrannheten och bestämma felet för måttet på molära absorbering av provet i övning 1, utspäds provet successivt i hälften av koncentrationen och transmittansen mäts i varje fall.
Från CO = 4 × 10^-4 M med transmittans t = 0,06 Följande datasekvens för transmittans och absorbans beräknad från transmittansen erhålls:
CO/1-> 0,06-> 1,22
CO/2-> 0,25-> 0,60
CO/4-> 0,50-> 0,30
CO/8-> 0,71-> 0,15
CO/16-> 0,83-> 0,08
CO/32-> 0,93-> 0,03
CO/64-> 0,95-> 0,02
CO/128-> 0,98-> 0,01
CO/256-> 0,99-> 0,00
Med dessa data, gör:
Det kan tjäna dig: stationära vågor: formler, egenskaper, typer, exempela) En graf över absorbans baserat på koncentration.
b) en linjär justering av data och hitta lutningen.
c) Beräkna den molära absorbering från den erhållna lutningen.
Lösning
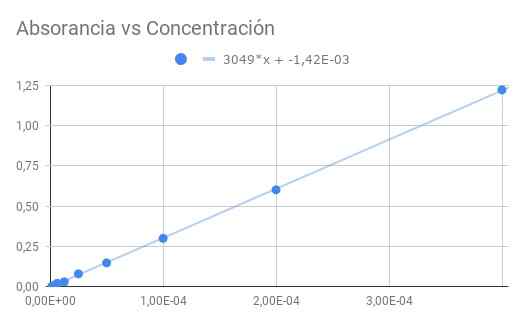 Figur 3. Absorbans mot koncentration. Källa: f. Zapata.
Figur 3. Absorbans mot koncentration. Källa: f. Zapata. Den erhållna lutningen är produkten av molär absorganivitet med det optiska avståndet, så dela lutningen med längd 1,5 cm vi får molabsorberande
ε = 3049/1,50 = 2033 (M⋅CM)^-1
Övning 3
Med uppgifterna från övning 2:
a) Beräkna absorganiviteten för varje data.
b) Bestäm ett medelvärde för molär absorbitet, dess standardavvikelse och det statistiska felet associerat med genomsnittet.
Lösning
Molarabsorbering beräknas för var och en av de testade koncentrationerna. Kom ihåg att belysningsförhållandena och optiskt avstånd förblir fixerade.
Resultaten för molär absorbitet är:
2033, 2007, 2007, 1983, 2158, 1681, 2376, 1 872, 1862 i enheter av 1/(m*cm).
Från dessa resultat kan vi ta medelvärdet:
= 1998 (m*cm)^-1
Med en standardavvikelse på: 184 (m*cm)^-1
Det genomsnittliga felet är standardavvikelsen dividerat med kvadratroten för datanumret, det vill säga:
Δ = 184/9^0,5 = 60 (m*cm)^-1
Slutligen dras slutsatsen att det patenterade ämnet har en molabsorberande vid frekvens 589 nm producerad av en natriumlampa av:
= (2000 ± 60) (m*cm)^-1
Referenser
- Atkins, s. 1999. Fysisk kemi. Omega -utgåvor. 460-462.
- Guiden. Överföring och absorbans. Återhämtat sig från: kemi.Laguia2000.com
- Miljöstoxikologi. Transmittance, Absorbance and Law of Lambert. Återhämtat sig från: arkiv.Innovationumh.är
- Äventyrsfysik. Absorbans och överföring. Återhämtat sig från: rpfisica.Bloggfläck.com
- Sistofotometri. Återhämtad från: kem.Librettexts.org
- Miljöstoxikologi. Transmittance, Absorbance and Law of Lambert. Återhämtat sig från: arkiv.Innovationumh.är
- Wikipedia. Absorbans. Återhämtat sig från: Wikipedia.com
- Wikipedia. Spektrofotometri. Återhämtat sig från: Wikipedia.com
- « Latinamerikansk avant -garde -sammanhang, egenskaper, författare
- Totalitarism ursprung, egenskaper, orsaker och konsekvenser »

