Acetanylid (C8H9NO)
- 1816
- 444
- Johan Johansson
Vad är acetanylid?
De acetanylid (C8H9Nej) Det är en aromatisk amid som får flera ytterligare namn: N-acetilarilamin, N-Feenilacetamid och Atethanil. Det presenteras som en solid toalett i form av flingor, dess kemiska natur är amida, och som sådan kan den bilda brandfarliga gaser när man reagerar med starka reducerande medel.
Dessutom är det en svag bas, att kunna reagera med dehydratiserande medel som P2ANTINGEN5 Att komma från en nitril. Det konstaterades att acetanylid hade en smärtstillande medel och antipyretisk verkan och användes 1886 med antifebrinens namn. Cahn och P. Hippa.
1899 infördes acetylsalicylsyra (aspirin) på marknaden, som hade samma terapeutiska verkningar som acetanilid. När användningen av acetanylid är relaterad till utseendet på cyanos hos patienter - en konsekvens av metemoglobinemi inducerad av acetanylid - kasserades dess användning.
Därefter konstaterades att den smärtstillande och antipyretiska verkan av acetanylid bodde i en metabolit av denna så kallade paracetamol (acetoaminophen), som inte hade sina toxiska effekter, som Axelrod och Brodie föreslog.
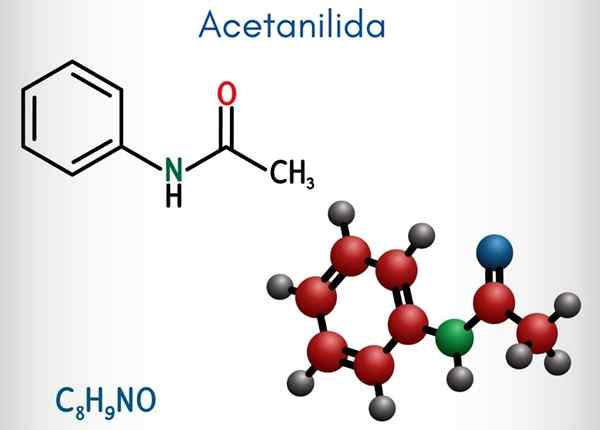
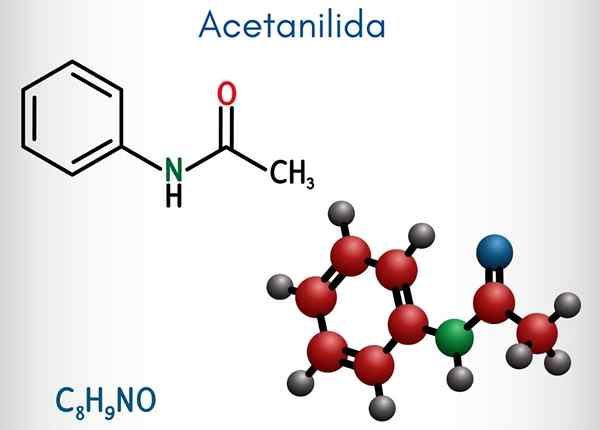
Kemisk struktur

I den övre bilden representeras den kemiska strukturen hos acetanylid. Till höger är den hexagonala aromatiska ringen av bensen (med prickade linjer), och vänster är orsaken till att föreningen består av en aromatisk amida: acetamidgruppen (HNCOCH3).
Acetamidgruppen ger bensenringen en större polär karaktär; Det vill säga skapa ett dipolmoment i atetanylidmolekylen.
Därför att? Eftersom kväve är mer elektronegativ än någon av kolatomerna i ringen och också är kopplad till acylgruppen, vars atom av eller också lockar elektronisk densitet.
Det kan tjäna dig: uretan: struktur, egenskaper, erhålla, användningarÅ andra sidan vilar nästan hela molekylstrukturen hos acetanylid på samma plan på grund av SP -hybridisering2 av atomerna som komponerar det.
Det finns ett undantag kopplat till gruppens3, vars väteatomer utgör vertikalerna hos en tetrahedron (de vita sfärerna i den vänstra änden lämnar planet).
Resonansstrukturer och intermolekylära interaktioner
Det ensamma vridmomentet utan att dela i Atomen i N Circulates genom π -systemet i den aromatiska ringen, och har sitt ursprung i flera resonansstrukturer. En av dessa strukturer slutar emellertid med den negativa belastningen i atomen av O (mer elektronegativ) och en positiv belastning i atomen i N.
Således finns det resonansstrukturer där en negativ belastning rör sig i ringen och en annan där den finns i atomen eller. Som en följd av denna "elektroniska asymmetri"-som kommer från handen av molekylär asymmetri-, interagerar acetanyliden intermolekylärt av dipol-dipolo-krafter.
Vätebroarinteraktioner (N-H-O-...) mellan två acetanylidmolekyler är emellertid faktiskt den dominerande kraften i dess kristallina struktur.
På detta sätt består acetanylidkristaller av ortorrhrombiska enhetsceller med åtta molekyler orienterade med former av "platta band" av deras vätebroar.
Ovanstående kan visualiseras om en acetanylidmolekyl placeras ovanpå den andra, parallellt. Så som Hncoch -grupper3 De överlappar maximalt, de bildar vätebroar.
Mellan dessa två molekyler kan det också "stulas" en tredje, men med sin aromatiska ring som pekar på motsatt sida.
Kan tjäna dig: Bromotimol BlueKemiska egenskaper hos acetanylid
 Appealid utseende
Appealid utseende Molekylvikt
135,166 g/mol.
Kemisk beskrivning
Vit eller gråaktigt fast. Bilda ljusa vita flingor eller ett kristallint vitt pulver.
Lukt
Toalett.
Smak
Lätt.
Kokpunkt
304 ºC till 760 mmHg (579 ºF vid 760 mmHg).
Smältpunkt
114,3 ºC (237,7 ºF).
Blixt eller brandfarlighet
169 ºC (337 ºF). Mätning gjord i öppet glas.
Densitet
1 219 mg/ml vid 15 ° C (1 219 mg/ml vid 59 ºF)
Ång-densitet
4.65 med luftrelation.
Ångtryck
1 mmHg vid 237 ºF, 1,22 × 10-3 mmHg vid 25 ºC, 2A vid 20 ° C.
Stabilitet
Det lider av en kemisk bakre reglo när den utsätts för ultraviolett ljus. Hur förändras strukturen? Acetylgruppen bildar nya länkar i ringen i orto -positionerna och för. Dessutom är det stabilt i luften och är oförenlig med starka oxidationsmedel, caustics och alkalis.
flyktighet
Märkbart flyktigt vid 95 ºC.
Självstyrelse
1004 ºF.
Sönderfall
Det sönderdelas när det upphettas och avger en mycket giftig rök.
pH
5 - 7 (10 g/l h2Eller 25 ºC)
Löslighet
- I vatten: 6,93 × 103 mg/ml vid 25 ° C.
- 1 g löslighet av acetanylid i olika vätskor: i 3,4 ml alkohol, 20 ml kokande vatten, 3 ml metanol, 4 ml aceton, 0,6 ml kokande alkohol, 3,7 ml kloroform, 5 ml gliecerol, 8 ml av dioxan, 47 ml bensen och 18 eter. Klorhydrat ökar lösligheten för acetanilid i vatten.
Syntes
Det syntetiseras genom att reagera ättiksyraanhydrid med acetanylid. Denna reaktion visas i många organiska kemi -texter (Vogel, 1959):
C6H5Nh2 + (Ch3Co)2O => c6H5Nhcoch3 + Ch3Cooh
Det kan tjäna dig: borax: historia, struktur, egenskaper, användningar, syntes, riskerAnsökningar
- Det är ett hämmarmedel för nedbrytningsprocessen för väteperoxid (väteperoxid).
- Stabilisera lacken från cellulosaestern.
- Ingriper som en mellanhand i accelerationen av gummiproduktion. På samma sätt är det mellanhand i syntesen av vissa färgämnen och kamfer.
- Det fungerar som en föregångare i syntesen av penicillin.
- Det används vid produktion av 4-acetamidefonilbenzenklorid. Acetanylid reagerar med klorosulfonsyra (HSO3Cl), vilket producerar kloriden av 4-aminosulfonilbenzen. Detta reagerar med ammonium eller en primär organisk amin för att bilda sulfonamider.
- Det användes experimentellt under 1800 -talet i utvecklingen av fotografering.
- Acetanylid används som en markör för elektroosmotiska flöden (EOF) i kapillärelektrofores för att studera kopplingen mellan läkemedel och proteiner.
- Nyligen har 1- (ω-fenoxialkiluracilo) anslutit sig till hämning i hämningsexperiment av hepatit C-virusinhibitionsexperiment. Acetanylid går med position 3 i pyrimidinringen.
- Experimentella resultat indikerar en minskning av replikationen av viralt genom, oavsett viral genotyp.
- Innan det identifierades toxiciteten för acetanylid användes den som smärtstillande medel och antipyretiskt från 1886. Därefter (1891) användes den vid behandling av kronisk och akut bronkit av Grün.