Ammoniumacetatstruktur, egenskaper, användningar och risker

- 4756
- 855
- Lars Eriksson
han Ammoniumcetat Det är ett oorganiskt salt vars kemiska formel är NH4Ch3Cooh. Det härstammar från blandningen av ättiksyra, närvarande i kommersiell vinäger till en 5%koncentration, och ammoniak. Båda startämnena har karakteristiska luktar, så det är möjligt att få en uppfattning om varför detta salt luktar som vinäger-ammoni.
Men den mest höjdpunkten i detta salt är inte dess lukt, utan dess låga smältpunkt. Det är så lågt att det i alla laboratorier kan erhållas i sin flytande version, där joner flyter fritt för att transportera elektriska belastningar.
 Ammoniumacetatkristaller. Källa: Vidak [Public Domain].
Ammoniumacetatkristaller. Källa: Vidak [Public Domain]. Å andra sidan är ammoniumacetatet utsökt; det vill säga absorbera vatten eller fuktighet i miljön tills den är helt upplöst. Det är därför, även om de i vattenfritt tillstånd är vita, blir de snabbt ljusa (som de i bägaren på den övre bilden).
Som en solid källa till ammoniak måste den manipuleras på ett sådant sätt att inandningen av dess ångor minimeras. Men trots denna negativa egenskap, NH4Ch3COOH är användbart för beredning av buffertlösningar som mat behåller, medan det är en del av vissa lösningsmedelsproteinekstraktorer.
[TOC]
Ammoniumacetatstruktur
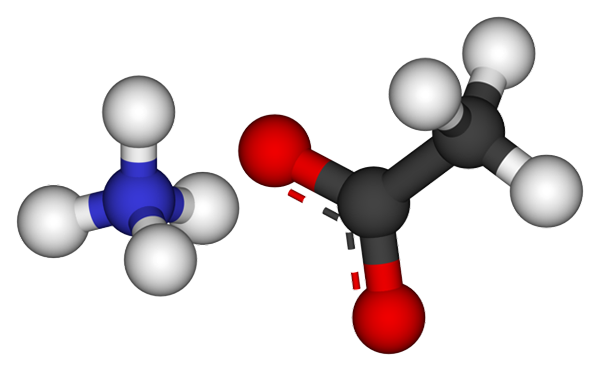 Ammoniumacetatjoner. Källa: CCOIL [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Ammoniumacetatjoner. Källa: CCOIL [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Den övre bilden visar jonerna som utgör ammoniumacetatet i en sfärer och staplar -modell. Till vänster är den tetraedrala geometri -katjonen, NH4+, Medan du är till höger3Kuttra- (Den streckade linjen mellan de röda sfärerna).
Således båda jonerna, NH4+ och ch3Kuttra-, De förblir förenade av sin elektrostatiska attraktion som, tillsammans med repulsionerna mellan lika belastningar, slutar definiera en kristall. Denna ammoniumacetatkristall har en ortorrombisk struktur, som kan observeras i mikroskopiska prover eller till och med synliga storlekar.
Kan tjäna dig: jonisk länk: egenskaper, hur den bildas och exempelInte bara är den joniska bindningen för detta salt viktigt, men det är också vätebroar. Nh4+ Du kan donera upp till fyra av dessa broar; Det vill säga, i var och en av topparna i tetrahedronen finns en syreatom från en cho3Kuttra- granne (h3N+-H-or3).
I teorin bör krafter inuti sina kristaller då vara mycket starka; Men experimentellt inträffar det motsatta, eftersom det smälter bara 114 ° C. Därför kompenserar inte vätebroar för svagheten i deras joniska bindning, och inte heller den låga retikulära energin i NH -ortorrhrombiskt glas4Ch3Kuttra.
Andra kompositioner och vatten
Det sades i början att ammoniumacetat framställs genom att blanda ättiksyra och ammoniaksyra. Därför kan salt också uttryckas som: NH3Ch3Cooh. Beroende på sammansättningen kan således andra strukturer erhållas: NH3· 2ch3COOH, O NH3· 5ch3COOH, till exempel.
Det nämndes också att det absorberar tillräckligt med fukt. På så sätt innehåller den vattenmolekyler till dess kristaller, som är hydrolyserade och ger NH3 eller ch3COOH; Och det är därför salt avger en lukt av ammoniak eller vinäger.
Egenskaper
Fysiskt utseende
Delicuescent vita kristaller med en lukt av vinäger och ammoniak.
Molmassa
77,083 g/mol.
Densitet
1 073 g/ml vid 25 ° C.
Smältpunkt
114ºC. Detta värde är betydligt lägre jämfört med andra salter eller joniska föreningar. Dessutom saknar det en kokpunkt på grund av bildandet av ammoniak, vilket innebär nedbrytning av salt.
Löslighet
143 g/100 ml vid 20 ° C. Notera din extraordinära vattenlöslighet, som visar den affinitet som vattenmolekyler känner på NH -jonerna4+ och ch3Kuttra-, Hying dem på vattenhaltiga sfärer.
Kan tjäna dig: Hume-rothery reglerHans löslighet är inte sådan i mindre polära lösningsmedel. Till exempel i 100 ml metanol vid 15 ° C 7,89 g NH upplös4Ch3Kuttra.
Stabilitet
Det är läckert, så du bör undvika att lagra i våta utrymmen. Även medan absorberande vatten frigör ammoniak, och därför sönderdelas det.
Pka
9.9.
Denna konstant motsvarar ammoniumjonens surhet:
Nh4+ + B nh3 + Hb
Där HB är en svag syra. Om B -basen är vattnet kommer dess hydrolysreaktion att vara reaktion:
Nh4+ + H2Eller NH3 + H3ANTINGEN+
I vilken art h3ANTINGEN+ Definiera lösningens pH.
Å andra sidan bidrar acetat också till pH:
Ch3Kuttra- + H2Eller ch3COOH + OH-
Således båda arter h3ANTINGEN+ och åh- De neutraliseras genom att ge en pH 7, neutral. Enligt PubChem har emellertid mycket koncentrerade lösningar av ammoniumacetat ett surt pH; vilket innebär att NH -hydrolys dominerar4+ Om valet3Kuttra-.
Standardträning entalpi
ΔFH298 = -615 kJ/mol.
Ansökningar
Analytisk
Vattenhaltiga natriumacetatlösningar tillåter bly-, järn- och zinksulfater att solubiliseras för att därefter bestämma deras koncentration genom atomabsorptionsspektroskopi.
Halvförare
Som måltider med låg temperatur jämfört med andra salter kan dess vätska användas för att driva den elektriska strömmen som slår på en glödlampa.
Buffert
Du kan reglera pH -förändringar i sura eller grundläggande intervaller, som används för att upprätthålla ett konstant pH i till exempel kött, choklad, ostar, grönsaker eller andra livsmedelsprodukter.
Kan tjäna dig: molybdenPå is och golv
Det är ett biologiskt nedbrytbart och relativt billigt salt, som används för att avfrosta isiga vägar. Eftersom det är en källa till vattenlösligt kväve är det också avsett för jordbruksbruk för bestämning av kaliumnivåer.
Fällande medel
Detta salt används för att fälla ut protein för att utföra kromatografisk analys.
Medicin
Ammoniumacetat fungerar som ett veterinärdiuretiskt medel, och det är också ett nödvändigt salt för insulin- och penicillinsyntes.
Risker
Därefter listas några negativa risker eller konsekvenser orsakade av ammoniumacetatet:
- Det kan ge små irritationer på huden, men utan att absorbera i den.
- När intaget orsakar mage, diarré, diuresis, ångest, större behov av att urinera, skakningar och andra symtom relaterade till ammoniakförgiftning, samt skada levern.
- Hans inandning irriterar näsan, halsen och lungorna.
Av resten är det okänt om cancer kan generera, och eventuell risk för eld genom detta salt kasseras (åtminstone under normala lagringsförhållanden).
Referenser
- Inger Nahringbauer. (1967). Vätebindningsstudier. Xiv. Kristallstrukturen i ammoniumacetat. Institute of Chemistry, University of Uppsala, Uppsala, Sverige. Kristall. 23, 956.
- Nationellt centrum för bioteknikinformation. (2019). Ammoniumcetat. Pubchemdatabas. CID = 517165. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Sullivan Randy. (2012). Konduktivitet hos ammoniumacetat. Återhämtat sig från: Chemdemos.Uoregon.Edu
- Viachem, Ltd. (s.F.). Ammoniumcetat. Återhämtat sig från: Viacheminc.com
- Wikipedia. (2019). Ammoniumcetat. Hämtad från: i.Wikipedia.org
- New Jersey Department of Health. (2012). Ammoniumacetat: Informationsblad om farliga ämnen. [Pdf]. Återhämtat sig från: nj.Gov
- Xueyanghu. (s.F.). Användning och risker för ammoniumacetat. Återhämtat sig från: Xueyanghu.WordPress.com
- « Alizarinegenskaper, beredning, användningsområden och toxicitet
- Järnhydroxid (III) struktur, egenskaper och användningar »

