Natriumacetatstruktur, egenskaper, syntes, användningar

- 2824
- 663
- Johan Olsson
han natriumacetat Det är ett natriumsalt av ättiksyra vars molekylformel är c2H3ANTINGEN2Na. Den består av ett vitt vitt pulver, närvarande i två former: vattenfri och trihydrat. Båda är mycket lösliga i vatten, det universella lösningsmedlet; Men inte så lösligt i alkoholer eller aceton.
Anhydraformen har en densitet, en fusion och kokpunkt med högre värden än de som presenteras av trihydratformen av natriumacetat. Detta beror på att vattenmolekyler stör mellan Na -joninteraktioner+ och ch3Kuttra-.
 Natriumacetatutseende
Natriumacetatutseende Natriumacetat är stabilt, särskilt om det lagras mellan 2 och 8 ºC; Men det är mottagligt för verkan av starka oxidationsmedel och halogener.
Det kan framställas genom reaktionen av natriumbikarbonat med ättiksyra. Också med reaktionen av ättiksyra med natriumhydroxid. Båda reaktionerna är enkla att utarbeta och låga ekonomiska kostnader; Den första kan till och med göras hemma.
Detta salt är lite giftigt förening. Producerar en irritation i huden, först efter en ofta och kontinuerlig kontakt. Det är lite irriterande för ögonen men kan irritera luftvägarna. Det finns ingen information om en skadlig effekt av ditt intag.
Den har många användningsområden och applikationer, som belyser dess pH -dämpningsfunktion, tillsammans med ättiksyra. Acetat stötdämparen har en PKA = 4,7; som ger hög effektivitet i regleringen av pH i en sur miljö med pH -värden mellan 3 och 6.
På grund av dess låga toxicitet och dess egenskaper har den använts för att förbättra smaken på mat, liksom ett medel som ger skydd mot deras sönderdelning på grund av deras verkan mot mikrober.
[TOC]
Natriumacetatstruktur
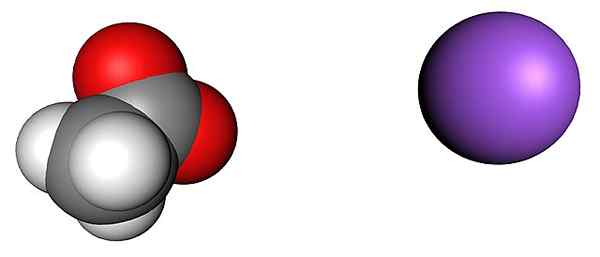 Acetat- och natriumjoner. Källa: SHU0309 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Acetat- och natriumjoner. Källa: SHU0309 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Den övre bilden visar jonerna som utgör de vattenfria natriumacetatkristallerna (utan vatten). Den lila sfären motsvarar na katjonen+, Och molekyljonen till vänster är acetat, cho3Kuttra-, Med sina syreatomer representerade av röda sfärer.
Dessa kamrater, enligt chipet ch3Stig, är i en 1: 1 -andel; För varje cho3Kuttra-, Det måste finnas en katjon+ lockas av dess negativa belastning och vice versa. Således slutar attraktioner mellan dem och avstötningar mellan lika belastningar med strukturella mönster som definierar en kristall, vars minimala uttryck är den enhetliga cellen.
Denna enhetliga cell, som glaset som helhet, varierar beroende på dispositionen av jonerna i rymden; Det är inte alltid detsamma, även för samma kristallina system. Till exempel kan vattenfritt natriumacetat bilda två ortorrombiska polymorfer, varav en representeras nedan:
 Enhetscell av natriumacetat ortorrombiska kristaller. Källa: Benjah-Bmm27 [Public Domain]
Enhetscell av natriumacetat ortorrombiska kristaller. Källa: Benjah-Bmm27 [Public Domain] Notera arrangemanget av jonerna: fyra cho -joner3Kuttra- De omsluter en na+ på ett sådant sätt att de "ritar" en förvrängd fyrkantig baspyramid. Var och en av dessa cho3Kuttra- i sin tur interagera med en annan NA+ intilliggande.
Hydratiserade kristaller
Natriumacetat har mycket affinitet för vatten; I själva verket är det läckert, det vill säga det behåller fukt tills den är upplöst i samma. Ju större fukt, förr är det "smälter". Detta beror på att så så3Kuttra- Som NA+ De kan hydrera, omge sig med vattenmolekyler som leder sina dipoler mot sina laster (NA+ Åh2, Ch3Kuttra- Hoh).
Kan tjäna dig: Silver Bromide (AGBR): Struktur, egenskaper och användningarNär detta salt framställs i laboratoriet eller hemma är det en sådan affinitet för vatten att även vid normala temperaturer redan erhålls som hydrat; Ch3PATA · 3H2ANTINGEN. Deras kristaller upphör att vara ortorrombiska och bli monokliniska, eftersom de nu innehåller tre vattenmolekyler för varje par Cho3Kuttra- och na+.
Egenskaper
Namn
-Natriumacetat.
-Natriumetanoat (IUPAC).
Molmassa
-Vattenfri: 82,03 g/mol.
-Trihydratiserad: 136,03 g/mol.
Aspekt
Delicuescent vitt pulver.
Lukt
Till vinäger när han värms upp för att sönderdelas.
Densitet
-Anhidro: 1, 528 g/cm3 vid 20 ºC.
-Trihydratiserad: 1,45 g/cm3 vid 20 ºC.
Smältpunkt
-Anhidro: 324 ºC (615 ºF, 597 K).
-Triohydrat: 58 ºC (136 ºF, 331 K).
Kokpunkt
-Anhidro: 881,4 ºC (1.618,5 ºF, 1.154,5 K).
-Trihydrat: 122 ºC (252 ºF, 395 K). Det sönderdelas.
Löslighet
I vatten
-Anhydro: 123,3 g/100 ml vid 20 ° C.
-Trihydratiserad: 46,4 g/100 ml vid 20 ºC.
I metanol
16 g/100 g vid 15 ºC.
I etanol
5,3 g/100 ml (trihydrat).
I aceton
0,5 g/kg vid 15 ° C.
Aciditet
PKA: 24 (20 ºC).
Basicitet
PKB: 9.25. Här är det uppenbart att natriumacetat är ett grundsalt för att behöva ha PKB mindre än dess PKA.
Brytningsindex (ηd)
1 464
Kaloriförmåga
-100,83 J/mol · k (vattenfri).
-229.9 J/mol · k (Trihydrado).
antändningspunkt
Över 250 ° C.
Självtemperatur
600 ºC.
pH
8.9 (lösning 0,1 m till 25 ºC).
Stabilitet
Stabil. Oförenlig med starka och halogenoxiderande medel. Fukt.
Reaktioner
Natriumacetat kan bilda en ester genom att reagera med en hyreshalogenid; Till exempel bromoetano:
Ch3Poron +brch2Ch3 => Ch3Cooch2Ch3 + Nabr
Natriumacetat är decarboxyla för att bilda metan (pyrolys) i närvaro av NaOH:
Ch3Poon +NaOH => Ch4 + Na2Co3
Reaktionen katalyseras av Cesio -försäljningen.
Syntes
Natriumacetat kan produceras till låg kostnad i laboratoriet genom att reagera natriumbikarbonat med ättiksyra:
Nahco3 + Ch3COOH => CH3Sökväg +h2Co3
Denna reaktion åtföljs av närvaron i lösningen av en intensiv bubbla på grund av nedbrytning av kolsyra i vatten och koldioxid.
H2Co3 => H2Eller +co2
Industriellt produceras natriumacetat genom reaktion av ättiksyra med natriumhydroxid.
Ch3COOH +NAOH => Ch3Sökväg +h2ANTINGEN
Ansökningar
Termiska påsar
Natriumacetat används för tillverkning av termiska väskor.
Ursprungligen upplöstes saltkristaller i en volym vatten för framställning av en lösning som blir övermättad.
Då värmer lösningen av vid en temperatur som är större än 58 ºC, vilket är dess smältpunkt. Den övermättade lösningen vid rumstemperatur får svalna och bildandet av kristaller observeras inte; Lösningen är över -chirp.
Kan tjäna dig: periodisk tabell, vad är det förFrånvaron av kristaller förklaras att vätskemolekylerna är för röriga och inte har vederbörlig vägledning för att uppnå kristallisationstemperaturen. Vätskan är i ett metastabelt tillstånd, ett obalansstillstånd.
Ge. När det gäller termiska påsar trycks en mekanisk fästning för att omröras och initiera bildandet av kristaller och stelningen av den trihydratiserade natriumacetatlösningen.
När kristallisationen inträffar ökar temperaturen. Trihydratiserad natriumacetatkristaller förvärvar isutseendet, men de är heta, så det kallas "het is".
Industriister
-Natriumacetat används i textilindustrin som en mordant i vävnadsfärgningsprocessen
-Neutralisera svavelsyravfall
-Den har användning i bomullsbearbetning för utarbetande av bomullskuddar, användbar vid personlig rengöring och för medicinska ändamål
-Det används i metallkylning, före dess krom
-Samarbetar så att vulkaniseringen av kloropren inte förekommer i den syntetiska gummiproduktionsprocessen
-Ingriper i rening av glukos
-Det används i skinns garning.
Medicinsk användning
Natriumacetat är en del av föreningarna som används för att leverera elektrolyter som administreras till patienter intravenöst.
Det används för att korrigera natriumnivåer hos hyponatemiska patienter, även i korrigering av metabolisk acidos och urinalkalinering.
PH -dämpningslösning
Det används som en pH -regulator i många enzymatiska reaktioner som inträffar mellan pH 3 och pH 6.
Det olika pH för acetatbuffertlösningen uppnås genom variationen i koncentrationen av ättiksyra och natriumacetat.
För att till exempel erhålla en pH 4,5 har buffertlösningen en koncentration av ättiksyra av 3,8 g/L och en koncentration av vattenfritt natriumacetat på 3,0 g/L.
Koncentrationen av acetatbuffertlösningen kan ökas, vilket i samma andel ökar komponenterna i den nödvändiga lösningen för att erhålla önskat pH.
Acetat/acetonitril stötdämpare används vid kapillärelektrofores vid fotorberberin separering.
Forskningslaboratorier
-Natriumacetat är ett svagt nukleofilt medel som används vid anjonisk polymerisation av p-lakton.
-Det används som ett reagens i den kärnmagnetiska resonansen av biologiska makromolekyler.
-Det används vid extraktionen av cellerna i cellerna. Natrium är en katjon som interagerar med de negativa massorna av fosfater som finns i DNA, vilket hjälper till med dess kondensation. I närvaro av etanol bildar DNA en fällning som sedan kan separeras i det vattenhaltiga skiktet.
Matbevarande
-Det hjälper till att förhindra bakterietillväxt, förutom att förhindra generering av överskott av surhet som orsakar försämring av maten och därmed bibehåller ett specifikt pH.
-Natrium som finns i acetat förbättrar smaken på mat.
-Natriumacetat används vid framställning av vegetabiliska pickles: gurka, morot, lök, etc. Dessutom används det i köttbevarande.
Kan tjäna dig: dimetylanylin: struktur, egenskaper, syntes, användningBevaring av betong
Betongen skadas av vattenverkan som förkortar dess varaktighet. Natriumacetat fungerar som ett betongtätningsmedel som vattentät det till vatten och förlänger dess initiala egenskaper.
Unga experiment
Experiment 1
Ett enkelt experiment är natriumacetatsyntes genom natriumbikarbonatreaktionen med vinäger (5%ättiksyra).
30 ml vinäger placeras i en bägare och cirka 3,5 g bikarbonat tillsätts.
I reaktionen bildas natrium- och kolsyraformer. Syra bryts ned i koldioxid och vatten. Generering av koldioxid kommer att producera en intensiv bubbla inom lösningen.
För att samla natriumacetat orsakas vattenindunstning, uppvärmning av lösningen.
Experiment 2
Ett annat enkelt experiment är bildandet av natriumtrihydratacetat.
För att göra detta, cirka 20 g natriumacetat trihydrat och placeras i en bägare, tillsätt sedan 10 ml vatten och tillsätter sedan 10 ml vatten. Lösningen upphettas till en temperatur större än 58 ºC.
Natriumacetat är helt upplöst för att säkerställa att lösningen är övermättad. Tidigare placeras en pietri -kapsel på en kall yta.
Innehållet i bägaren med trihydratacetat i Pietri's kapsel hälls långsamt. Vätsketemperaturen i kapseln börjar stiga ner, även under smältpunkten, utan att observera kristallisationen eller stelningen av trihydrat -natriumacetatet.
Vanligtvis för att producera kristallisationen av trihydratiserad natriumacetat tillsätts en liten mängd salt för att tjäna som en kristallisationskärna. Andra gånger finns det en liten störning av lösningen för att initiera kristallisationen av natriumacetat.
De trihydratiserade natriumacetatkristallerna ser ut som isen, men om de berörs kommer det att märkas att de är relativt heta. Av denna anledning kallas salt "het is".
Giftighet
Natriumacetat är en mycket liten giftig förening. Det klassificeras inte heller som en sensibilisator för hud och luftvägar.
Dessutom klassificeras natriumacetat inte som ett mutagen medel i groddar, cancerframkallande eller toxiska celler för reproduktion.
Kort sagt, det är lite irriterande för ögonen. Luftvägarna kan irriteras efter inandning. Ofta och konstant kontakt med huden kan orsaka dess irritation.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Världsdelar. (16 januari 2017). Hur man förbereder natriumacetat hemma? Återhämtat sig från: medium.com
- Nationellt centrum för bioteknikinformation. (2019). Natriumacetat. Pubchemdatabas. CID = 517045. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- S. Cameron, K. M. Mannan och m. ANTINGEN. Rahman. (1976). Kristallstrukturen hos natriumacetat trihydrat. Kristall. B32, 87.
- Wikipedia. (2019). Natriumacetat. Hämtad från: i.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (24 januari 2019). Gör varm is från vinäger och bakpulver. Återhämtat sig från: tankco.com
- Kemisk bok. (2017). Natriumacetat. Återhämtat sig från: Chemicalbook.com
- Wasserman robin. (2019). Användning av natriumacetat. Återhämtat sig från: livestrong.com
- Drogbank. (2019). Natriumacetat. Återhämtat sig från: drugbank.Växelström

