Etylalkoholstruktur, egenskaper, användningar, erhållning
- 3724
- 920
- PhD. Emil Svensson
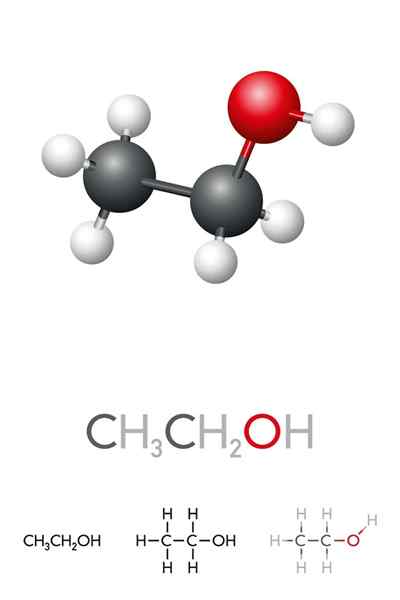
han Etylalkohol eller etanol Det är en organisk förening vars formel är c2H5Åh eller ch3Ch2Åh, presentera sig som en färglös vätska. Detta är den näst enklaste primära alkoholen av alla efter metanol. Det är mycket lösligt i vatten och i många organiska lösningsmedel, vilket har möjliggjort utvecklingen av många av dess tillämpningar.
Denna alkohol har använts som antiseptiskt och desinfektionsmedel, utöver dess användning vid syntes av läkemedel och andra organiska kemikalier. Det har också använts som bränsle i värmare, lampor och i kombination med bensin i motorfordon.

Jäsningen av socker för etanolproduktion är en av de första kemiska reaktionerna som den primitiva mannen lärde sig. En 9000 -årig keramik har hittats i Kina.
Men fermentering av sockerarter producerade endast en mycket låg koncentration av etanollösning, varför det var nödvändigt att lära sig destillationstekniker för att eliminera vatten och koncentrera alkohol. Således grekiska alchemister som arbetade i Alexandria på 1: a århundradet.C., De visste och använde redan destillation.
Det finns emellertid syntetiska vägar som möjliggör att få helt ren etanol baserat på eten, som destilleras från olja. Därför är olja en indirekt källa till etanol. På detta sätt erhålls etanol eller absolut alkohol.
[TOC]
Etylalkoholstruktur
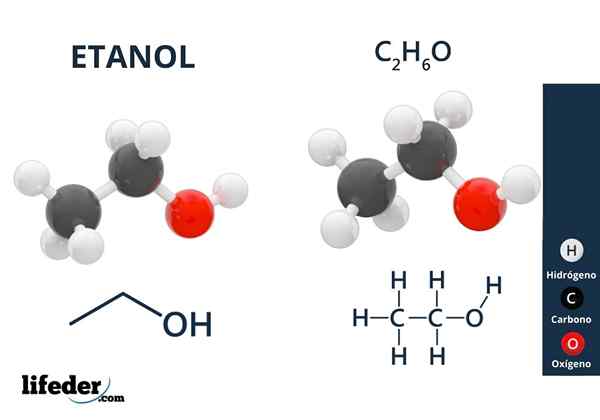
I den överlägsna bilden har vi molekylstrukturen för etanol, Cho3-Ch2-Åh, representerad av en full rymdmodell. Det är en ganska polär molekyl, eftersom OH -gruppen lockar elektronisk densitet mot sig själv av kolskelettet som det är kopplat.
Som ett resultat interagerar etylalkoholmolekyler genom dipol-dipol3Ch2Oh-ohch2Ch3. Det är därför denna alkohol har en hög kokpunkt jämfört med andra organiska lösningsmedel eller vätskor.
Egenskaper
Fysiskt utseende
Färglös vätska.
Molmassa
46.069 g/mol
Lukt
Mjuk lukt och liknande vin.
Smak
Bränna.
Densitet
0.789 g/cm3 vid 20 ºC
Smältpunkt
- 114.14 ºC
Kokpunkt
78.24 ºC
Vattenlöslighet
1 · 106 mg/l. Det vill säga det är praktiskt taget blandbart i alla proportioner.
Belopp med organiska lösningsmedel
Etanol är blandbar med ättiksyra, aceton, bensen, koltetraklorid, kloroform, dietyleter, etylenglykol, glycerol, pyridin och toluen. Det är också blandbart med lätta alifatiska kolväten, såsom Pentano och Hexano.
Oktanol/vattenpartitionskoefficient
Log P = - 0.31
Ångtryck
59.3 mm Hg vid 25 ºC. Därför avskedade en märkbar mängd ångor.
Kan tjäna dig: Bariumklorid (BACL2)Ång-densitet
1.59 i luftförhållandet taget som enhet (1)
antändningspunkt
13 ºC
Självriktningstemperatur
363 ºC
Förbränningsvärme
1336.8 kJ/mol a 25 ºC
Förbränning
Etanol är en flyktig vätska som brinner med en blå låga, utan rök, och som är praktiskt taget osynlig för naturligt ljus.
Specifik värme
0.618 kalk/g vid 23 ° C
Gegga
1.2 MPa · s vid 20 ºC
Brytningsindex ηd
1.3611
Användning av etylalkohol
 En av de vanligaste användningarna av alkohol är som antiseptisk
En av de vanligaste användningarna av alkohol är som antiseptisk Medicinsk användning
Antiseptisk
Etanol används som ett antiseptiskt, eftersom det har en dödlig verkan mot bakterier och svampar. Den kan förändra strukturen i dess plasmamembran, som producerar dess förstörelse genom de osmotiska vattenflödena som är etablerade.
På samma sätt kan etanol förstöra många typer av virus. För närvarande rekommenderas användningen av geler som innehåller alkohol för att desinficera händerna och minska smitta med koronaviruset. Etanol används också för desinfektion av ytliga mindre sår.
Narkotikalösningsmedel
Många mediciner är lite lösliga i vatten och använder etanol för att öka deras löslighet. Vissa spenar för hosta och munnsköljningar har en etanol -kontempid på upp till 25%.
Smärtbehandling
Etanol används för terapeutisk lysering av nerver eller ganglier för lättnad av kronisk oöverträfflig smärta, närvarande i inoperabel cancer eller i en trigeminal neuralgi.
Symtomatisk sköldkörtelcysterbehandling
Perkutana etanolinjektioner används vid behandling av sköldkörtelcyster, en enkel procedur som kan undvika komplikationer av kirurgisk ingripande.
Lugnande handling
Ibland administreras etanol intravenöst för preoperativ och postoperativ sedation, hos de patienter som andra åtgärder inte är användbara.
Motgift
Etanol används systemiskt för behandling av förgiftning med metanol eller etylenglykol.
Glaukom
Etanol används för att minska intraokulärt tryck hos glaukompatienter.
Bränsle
USA, tillsammans med Brasilien, konsumerar 90% av etanolen som används som bränsle i bilar. USA är den största majsproducenten i världen, så den använder majs som en källa till etanol som bränsle.
Regeringen subventionerade majsodlare, som ökade mellan 1979 och 1986 Produktionen av bränsleetanol på 20 miljoner liter per år till 750 miljoner liter.
Sockerrör är den viktigaste källan till etanol i Brasilien för användning som bränsle. 1943, på grund av andra världskriget.
Kan tjäna dig: deuteriumSedan 1976 har de använts som bränsle i bilar blandningar av etanol och bensin, vars etanolinnehåll sträcker sig mellan 10 och 25 %, beroende på sockerrörsproduktion.
Fritidsanvändning
Etanol finns i många drycker som används i sociala möten och till och med under lunch och familjemiddag.
Den första handlingen av alkohol för att desinhibitera personens sociala beteende ger en trevlig och underlättande miljö i interaktionen mellan människor. Överskott av etanol kan emellertid detonera giftiga och oönskade effekter på personlig hälsa och i harmoni mellan möten eller händelser.
Personlig vård
Etanol finns i många kosmetika och skönhetsprodukter. På grund av dess sammandragande verkan används den dessutom vid hudrengöring, vilket eliminerar fett och smutsiga rester som vatten och tvål inte gör det. Det är också en del av beredningen av många lotioner och parfymer.
Mat
Kärnan i vanilj, en smak av användning i kakor och kakor, löses i en blandning av etanol och vatten. Godisar som är fyllda med vissa alkoholhaltiga drycker säljs. Alkohol används också som en smak av vissa godis.
Att få etylalkohol
Etanol erhålls huvudsakligen genom sockerfermentering och etenhydrering, repeterar för att producera den från koldioxid, lipider och cellulosa.
Jäsning
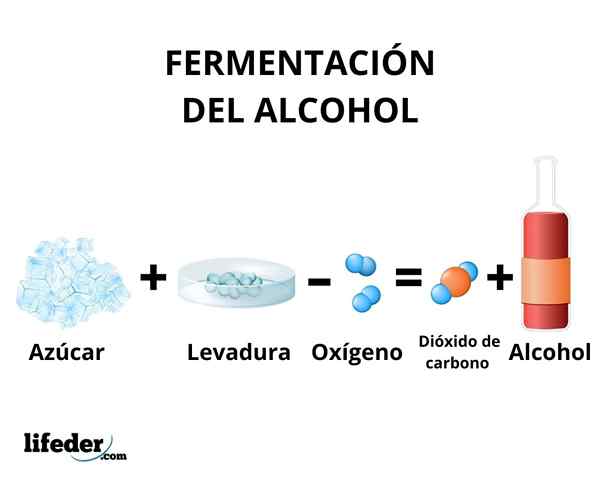
I jäsningsprocessen uppstår omvandlingen av kolhydrater i etanol genom verkan av enzymer som finns i jäst. Huvudsakligen används sockerrör, rödbeta och spannmål som majs och korn som råmaterial.
Enzymerna av glykolysen av vissa jästarter, till exempel Saccharomyces cerevisiae, De kan agera på glukos- och sackarossocker för att producera etanol. Koncentrationen av producerad etanol begränsas av jästens känslighet för etanol.
I alla fall överstiger inte koncentrationen av etanol som produceras genom jäsning 18%. Det är nödvändigt att koncentrera etanollösningen med enkel destillation. Genom denna metod erhålls en etanollösning med en koncentration runt 95%.
Slutligen används fraktionerad destillation och 95% alkoholuttorkning för absolut alkoholproduktion. Etanol som produceras genom jäsning används i medicin och är reserverad som ett bränsle som kompletterar bensin.
Etylenhydrering
I denna process blandas eten med höga temperaturer med avjoniserad ånga vid höga temperaturer, mellan 250 och 300 ° C, och under ett tryck av 6.8 MPa. Omvandlingen av eten till etanol katalyseras av fosforsyra placerad på en kiseldioxid eller diatoms landbädd.
Kan tjäna dig: Metallers mekaniska egenskaperEtylenhydreringsreaktion kan schematiseras enligt följande:
C2H4 + H2O → ch3Ch2Åh
En del av fosforsyran dras av vattenånga och bör neutraliseras med utspädd natriumhydroxid. Koncentrationen av etanol erhållen genom etenhydrering är låg, med ett värde mellan 10 och 25%.
Sedan koncentreras etanollösningen genom destillation och erhåller en 95% etanollösning, som kan genomföras 100% genom fraktionerad destillation och uttorkning.
Andra metoder
Från alternativa metoder för etanolproduktion har vi användning av koldioxid, lipider och cellulosa. Användningen av cellulosa är mer lovande, eftersom material som trä, halm, avfallspapper etc., Som en källa till cellulosa råmaterial. Cellulosa är en glukospolymer och kan användas som källa till detta kolhydrat.
Toxicitet och risker
 Hemlagade alkoholbåtar finns vanligtvis i en 70%-90%koncentration
Hemlagade alkoholbåtar finns vanligtvis i en 70%-90%koncentration Inandning
Höga koncentrationer av etanolång kan orsaka dåsighet, ögonirritation och övre luftvägar, manifesteras av hosta och huvudvärk.
Direktkontakt med hud och ögon
Hudkontakt kan orsaka torrhet och, kronisk, irritation och dermatit. Samtidigt producerar ögonkontakt irritation, rodnad, smärta och brinnande känsla.
Intag
Producerar en brinnande känsla och till en början har den en stimulerande och trevlig handling på grund av den producerade desinhibitionen. Men när alkoholintaget fortsätter finns det en nervdepression, huvudvärk, suddig syn, dåsighet och medvetslöshet.
Kroniska effekter
Etanol påverkar det centrala nervsystemet och övre luftvägarna. Dessutom kan leverskadorna orsakade av intag av etanol leda till cirrhos och därefter död.
Referenser
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. (10th Utgåva.). Wiley Plus.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Morrison och Boyd. (1987). Organisk kemi. (Femte upplagan). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Etanol. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2020). Etanol. Pubchem Comunund -sammanfattning för CID 702. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Etanolhistoria. (2011). Etanolhistoria - från alkohol till bilbränsle. Återhämtat sig från: etanolhistory.com
- Redaktörerna för Enyclopaedia Britannica. (2020). Etanol. Återhämtat sig från: Britannica.com
- Korviverad. (15 oktober 2000). Säkerhetsblad (MSD) etylalkohol. [Pdf]. Återhämtat sig från: iio.Fog.UABC.mx
- Byju. (2020). Användning av metanol och etanol. Återhämtat sig från: byju.com
- Helmestine, Anne Marie, PH.D. (25 augusti 2020). Skillnaden mellan alkohol och etanol. Återhämtat sig från: tankco.com

