Tertiär alkoholstruktur, egenskaper, exempel
- 4084
- 61
- PhD. Emil Svensson
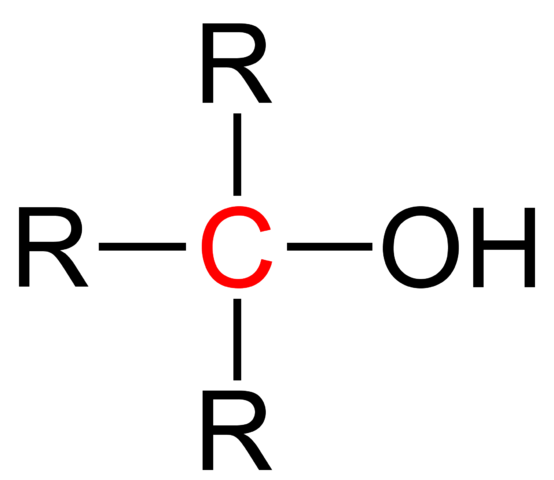
En Tertiär alkohol Det är en där hydroxylgruppen, OH, är kopplad till ett tertiärt kol. Dess formel fortsätter att vara ROH, som andra alkoholer; Men det är lätt att känna igen eftersom OH är nära ett X i molekylstrukturen. Dessutom är dess kolsyrade kedja vanligtvis kortare och dess huvudsakliga molekylmassa.
Då tenderar en tertiär alkohol att vara tyngre, den är mer grenad, och den är också det minst reaktiva med avseende på oxidation; Det vill säga att det inte kan förvandlas till en keton eller karboxylsyra som inträffar med sekundära respektive primära alkoholer.
 Strukturell formel av en tertiär alkohol. Källa: Jü [Public Domain].
Strukturell formel av en tertiär alkohol. Källa: Jü [Public Domain]. Den allmänna strukturella formeln för en tertiär alkohol visas i den övre bilden. Enligt henne kunde en ny formel av r -typen skrivas3COH, där R kan vara en alkyl- eller arylgrupp; En methilo -grupp, ch3, eller en kort eller lång kolsyrad kedja.
Om de tre R -grupperna är olika kommer det centrala kolet i tertiär alkohol att vara kiral; det vill säga alkohol kommer att presentera optisk aktivitet. För detta faktum debiterar de tertiära quirala alkoholerna ränta inom läkemedelsindustrin, eftersom dessa alkoholer från ketoner med biologisk aktivitet syntetiseras med mer komplexa strukturer.
[TOC]
En tertiär alkohol
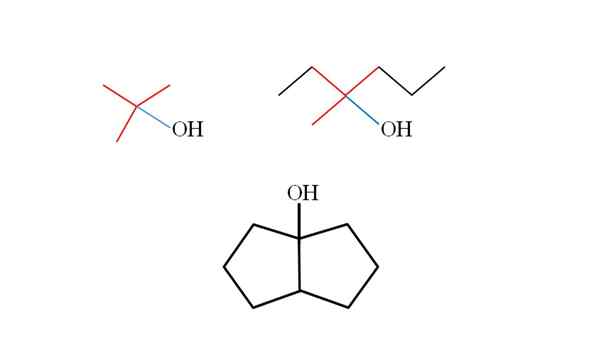 Tre tertiära alkoholer och deras strukturer. Källa: Gabriel Bolívar.
Tre tertiära alkoholer och deras strukturer. Källa: Gabriel Bolívar. Tänk på strukturerna i de övre tertiära alkoholerna för att lära sig att känna igen dem oavsett föreningen. Kolet kopplat till OH måste också kopplas till tre andra kolhydrater. Om det observeras i detalj uppfyller de tre alkoholerna detta.
Den första alkoholen (till vänster) består av tre grupper Ch3 Centralt kol kopplat, vars formel skulle vara (Cho3)3Koh. Hyresgruppen (välj3)3C- Det är känt som tertbutil.
Det kan tjäna dig: potentiometer (phameter)Den andra alkoholen (till höger) har den centrala kol lin3, Ch3Ch2 och ch2Ch2Ch3. Eftersom de tre grupperna är olika är alkohol kiral och uppvisar därför optisk aktivitet. En T observeras inte här, men en X nära OH (röd och blå).
Och i den tredje alkoholen (nedanstående och utan färger) är OH kopplat till en av de två kol som går med i två cyklopentano. Denna alkohol presenterar inte optisk aktivitet eftersom två av de centrala kolbindade grupperna är identiska. Liksom den andra alkoholen, om den noggrant observeras, kommer en x (snarare en tetrahedron) också att hittas.
Hinder
De tre överlägsna alkoholerna har något mer gemensamt än ett X: centralt kol förhindras steriskt; Det vill säga det finns många atomer som omger honom i rymden. En omedelbar konsekvens av detta är att nukleofiler, ivriga efter positiva laddningar, får svårigheter att närma sig detta kol.
Å andra sidan, med tre kol kopplade till det centrala kolet, donerar de en del av den elektroniska densiteten som den elektronegativa atomen i syre subtraktar det och stabiliserar det ännu mer framför dessa nukleofila attacker. Tertiär alkohol kan dock drabbas av substitution genom att bilda Carbocation.
Egenskaper
Fysisk
De tredje alkoholerna presenterar i allmänhet mycket grenade strukturer. En första konsekvens av detta är att OH -gruppen förhindras, och därför utövar dess dipolmoment en mindre effekt på angränsande molekyler.
Detta innebär svagare molekylära interaktioner jämfört med de för primära och sekundära alkoholer.
Kan tjäna dig: Le Châtelier -principenTänk till exempel på de strukturella isomererna av butanol:
Ch3Ch2Ch2Oh (n-Butanol, PEB = 117ºC)
(Ch3)2Ch2OH (isobutilisk alkohol, PEB = 107ºC)
Ch3Ch2Ch (oh) ch3 (Sekbutilisk alkohol, PEB = 98ºC)
(Ch3)3COH (tertbutilisk alkohol, PEB = 82ºC)
Observera hur kokpunkter går ner när isomeren blir mer grenad.
Först nämndes det att i strukturerna för alkoholer 3 observeras ett x, vilket i sig indikerar en hög gren. Det är därför dessa alkoholer tenderar att ha lägre smält- och/eller kokpunkter.
Något liknande är fallet för din blandbarhet med vatten. Ju mer förhindrad desto mindre blandbar OH kommer att vara alkohol 3 med vatten. Men denna blandbarhet minskar ju längre kolkedjan; Således är termisk alkohol mer löslig och blandbar med vatten än n-Butanol.
Aciditet
Tertiära alkoholer tenderar att vara de minsta syrorna av alla. Skälen är många och relaterar till varandra. Sammanfattningsvis konton, den negativa belastningen av dess härledda alkoxid, röd-, Du kommer att känna en stark avstötning för de tre alkalgrupperna som är kopplade till det centrala kolet och försvagar anjonen.
Ju mer instabil anjonen är, desto mindre kommer alkoholens surhet att vara.
Reaktivitet
3: e alkoholer kan inte drabbas av oxidationer till ketoner (R2C = O) eller aldehydos (RCHO) eller karboxylsyror (RCOOH). Å ena sidan skulle jag behöva förlora en eller två kol (i form av CO2) att oxidera, vilket minskar dess reaktivitet mot oxidation; Och å andra sidan saknar det väte som kan förlora för att bilda en annan koppling till syre.
Det kan tjäna dig: pyridin: struktur, egenskaper, användningar, toxicitet, syntesDe kan emellertid drabbas av substitution och eliminering (bildning av en dubbelbindning, en alken eller olefin).
Nomenklatur
Nomenklaturen för dessa alkoholer är inte annorlunda än andras. Det finns vanliga eller traditionella namn, och de systematiska namnen som styrs av IUPAC.
Om huvudkedjan och dess konsekvenser består av en erkänd hyresgrupp används den för dess traditionella namn; När det inte är möjligt att göra det används IUPAC -nomenklaturen.
Tänk till exempel på följande tertiära alkohol:
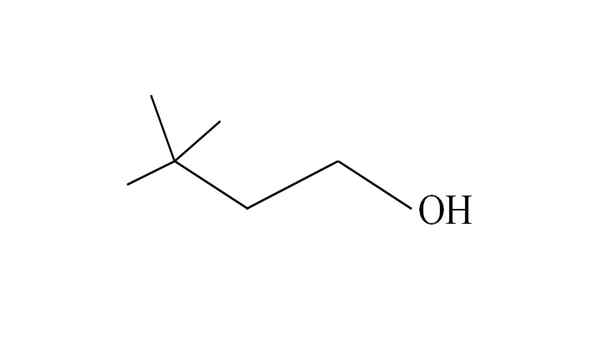 3,3-dimetyl-1-butanol. Källa: Gabriel Bolívar.
3,3-dimetyl-1-butanol. Källa: Gabriel Bolívar. Det börjar räkna kol från höger till vänster. I C-3 finns det två grupper Ch3 av substituenter, och därför är namnet på denna alkohol 3,3-dimetyl-1-butanol (huvudkedjan har fyra kol).
På samma sätt består hela kedjan och dess konsekvenser av neohexilo -gruppen; Därför kan dess traditionella namn vara neohexylalkohol eller neohexanol.
Exempel
Slutligen nämns några exempel på tertiära alkoholer:
-2-metyl-2-propanol
-3-metyl-3-hexanol
-Biciclo [3,3,0] oktan-1-ol
-2-metyl-2-butanol: CH3Ch2Coh (ch3)2
Formlerna för de tre första alkoholerna representeras i den första bilden.
Referenser
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. (5: e upplagan). Redaktör Addison-Wesley Inter-American.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. Aminer. (10: e upplagan.). Wiley Plus.
- Gunawardena gamini. (31 januari 2016). Tertiär alkohol. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Ashenhurst James. (16 juni 2010). Alkoholer (1) - Nomenklatur och egenskaper. Återhämtat från: Masterorganicchemistry.com
- Clark j. (2015). Introducerar alkoholer. Återhämtat sig från: Chemguide.co.Storbritannien
- Organisk kemi. (s.F.). Tema 3. Alkohol. [Pdf]. Återhämtat sig från: Sinorg.Uji.är
- Nilanjana majumdar. (3 mars 2019). Syntes av kiral tertiär alkohol: Betydande utveckling. Återhämtad från: 2.Kemi.Msu.Edu
- « Formativ period av Amerika ursprung, egenskaper, produkter
- Hur var det europeiska samhället under första hälften av 1800 -talet »

