Alosterism allmänna aspekter, funktioner och exempel

- 1915
- 35
- Prof. Erik Johansson
han Alosterism o Alostrisk reglering definieras som processen för hämning eller aktivering av ett enzym medierad av en regleringsmolekyl som skiljer sig från dess substrat och verkar på en specifik plats i dess struktur, skiljer sig från den aktiva platsen för samma.
Termen "alosterisk" eller "alosterism" kommer från de grekiska rötterna "allos ", vilket betyder "en annan" och "Stereós", vilket betyder "form" eller "plats"; Så bokstavligen översätter som "annat utrymme", "en annan plats" eller "en annan struktur".
 Grafiskt schema för a till teosterisk reglering. (A) Aktiv webbplats. (B) alosterisk plats. (C) underlag. (D) hämmare. (E) enzym. (Källa: Isaac Webb [CC BY-S (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] via Wikimedia Commons)
Grafiskt schema för a till teosterisk reglering. (A) Aktiv webbplats. (B) alosterisk plats. (C) underlag. (D) hämmare. (E) enzym. (Källa: Isaac Webb [CC BY-S (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] via Wikimedia Commons) Vissa författare beskriver alosterism som en process genom vilken avlägsna platser i ett system (till exempel strukturen för ett enzym) är energiskt kopplade för att producera ett funktionellt svar, varför det kan antas att en förändring i en region kan påverka alla andra i samma.
Denna typ av reglering är typisk för de enzymer som deltar i flera kända biologiska processer, såsom signaltransduktion, metabolism (anabolism och katabolism), regleringen av genetiskt uttryck, bland andra.
De första idéerna om alosterism och deras deltagande i kontrollen av cellulär metabolism postulerades på 1960 -talet av F. Monod, f. Jacob och J. Changeux, medan de studerade de biosyntetiska vägarna för olika aminosyror, som hämmades efter ansamlingen av de slutliga produkterna.
Även om den första publikationen i detta avseende hade att göra med genetisk reglering, utvidgade en kort tid senare Monod, Wyman och Changeux uppfattningen av alosterism till proteiner med enzymatisk aktivitet och föreslog en modell baserad på multimerproteiner, främst stöd av interaktioner mellan underenheter när några när några när det gäller några när några när några när några när några när några är några när några underenheter när några när några stöder några underenheter när några när några stöder någon av dessa gick med i en effektor.
Kan tjäna dig: Guanina: Egenskaper, struktur, träning och funktionerMånga av de efterföljande begreppen hade sin grund i teorin om "inducerad justering" som introducerades av Koshland några år innan.
[TOC]
Allmänna funktioner
I allmänhet har alla enzymer två olika platser för ligandförening: en är känd som det aktiva stället, som förenar molekylerna som fungerar som ett substrat (ansvarig för enzymets biologiska aktivitet), och den andra är den andra som är teosterisk webbplats, som är specifik för andra metaboliter.
Dessa "andra metaboliter" kallas alestheriska effektorer och kan ha positiva eller negativa effekter på hastigheten på reaktioner katalyserade av enzymer eller i den affinitet som de går med i sina underlag på den aktiva platsen.
Vanligtvis orsakar föreningen av en effektor på AL, ett enzymplats en effekt på en annan plats för strukturen, modifierar dess aktivitet eller funktionella prestanda.
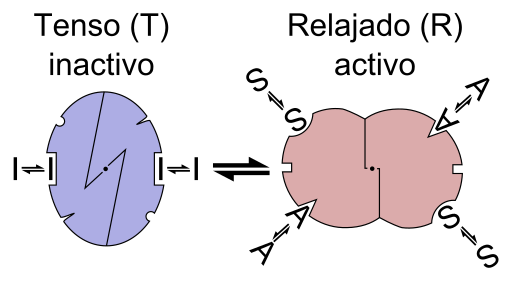 Grafiskt schema för reaktionen av en enzym alosterica (källa: Fil: enzymallosteri är.PNG: Fil: enzymallosteri.PNG: Allostery.PNG: Nicolas Le Novere (Talk).Lenov på.Wikipedierarivativ arbete: Timvickers (Talk) Derivatarbete: Retama (Talk) Derivatarbete: KES47 [CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0) via Wikimedia Commons)
Grafiskt schema för reaktionen av en enzym alosterica (källa: Fil: enzymallosteri är.PNG: Fil: enzymallosteri.PNG: Allostery.PNG: Nicolas Le Novere (Talk).Lenov på.Wikipedierarivativ arbete: Timvickers (Talk) Derivatarbete: Retama (Talk) Derivatarbete: KES47 [CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0) via Wikimedia Commons) Med andra ord, föreningen mellan en alestroeffektor till dess specifika plats i strukturen hos ett enzym orsakar en förändring i molekylgeometri för enzymet, som kallas övergången till teosteric, det vill säga det är en händelse som överförs överföras i hela makromolekylen, modifiera dess beteende.
Alosterism kan vara homotropisk eller heterotropisk. En homotropisk alostroisk regleringsprocess definieras som den där samma substrat för ett enzym fungerar som dess alestriska regulator, det vill säga att den alosteriska effekten är av samma substrat; Det är också känt som en typ av kooperativ.
En heterotropisk regleringsprocess, å andra sidan, hänvisar till regleringen av aktiviteten hos ett enzym medierat av en molekyl eller effektor av teosteric som skiljer sig från dess substrat och kan också ha positiva eller negativa effekter på aktiviteten hos enzymet eller enzymet.
Det kan tjäna dig: Aptenia cordifolia: egenskaper, livsmiljö, egenskaper, odlingFunktioner
Alosterism, tillsammans med reglering av genetiskt uttryck, översättning och proteinnedbrytning, är en av de grundläggande mekanismerna för reglering av ett stort antal organiska processer, vilket är viktigt för att upprätthålla homeostas och för överlevnad alla levande, unicellulära eller multicelliga varelser.
Toostalregleringen eller alosterism ger levande organismer förmågan att svara med stor känslighet för förändringar i koncentrationen av reglerande ligander, liksom den för att ursprungliga rytmiska fenomen på cellnivå.
Eftersom energi- och metaboliska substrat är ändliga i en cell, tillåter alosterism, inom det metaboliska fältet, den måttliga resurser, undviker både värdelösa cykler och slöseri med energi för överdriven bearbetning av substrat i överflödets förhållanden eller brist på brist.
På liknande sätt är denna regleringsmekanism av stor betydelse för cellsignaleringsprocesser, där många konformationella förändringar som utlöses av föreningen mellan olika ligander på specifika platser för de aktuella receptorerna är involverade.
Exempel på alosterism
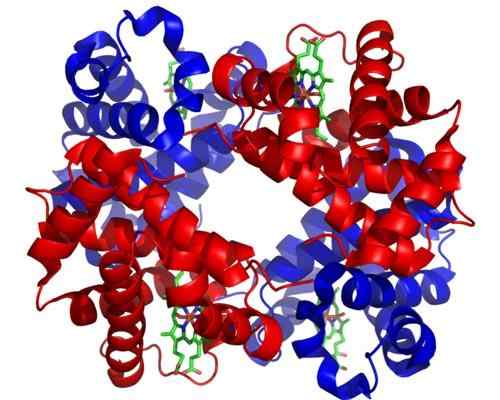 Hemoglobin. Tagen och redigerad från: Zephyris på engelska Wikipedia [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]].
Hemoglobin. Tagen och redigerad från: Zephyris på engelska Wikipedia [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]]. Även om det finns tusentals exempel på toosterism eller reglering i naturen, har vissa varit mer framträdande än andra. Så är fallet med hemoglobin, som var ett av de första proteinerna som beskrivs i djupet i den strukturella aspekten.
Hemoglobin är ett mycket viktigt protein för många djur, eftersom det ansvarar för transport av syre genom blodet från lungorna till vävnaderna. Detta protein presenterar homotropiskt och heterotropiskt till den posteriska regleringen samtidigt.
Kan tjäna dig: saltacionism: egenskaper, bevis och exempelHomotropisk alosterism av hemoglobin har att göra med föreningen av en syremolekyl till en av underenheterna som komponerar den direkt påverkar affiniteten med vilken underenheten intill en annan syremolekyl är bindande, vilket ökar den (positiv eller kooperativismreglering)).
Heterotropisk till det heterotropiska
Heterotropisk alosterism är å andra sidan relaterat till effekterna av både pH och närvaron av 2,3-diffoglycerat på föreningen av syre till underenheterna i detta enzym, vilket hämmar det.
Transcarbamilase eller Atcasa Aspartate, som deltar i pyrimidinsyntesvägen, är också ett av de "klassiska" exemplen på alosterisk reglering. Detta enzym, som har 12 underenheter, varav 6 är katalytiskt aktiva och 6 är regulatorer, hämmas heterotropiskt av den slutliga produkten av rutten som huvuden, cytidinatrifosfat (CTP).
Laktosoperon OCH. coli
Frukten av de första idéerna från Monod, Jacob och Changeaux var en artikel publicerad av Jacob och Monod relaterad till laktosen av laktosen i laktosen hos Escherichia coliYo, som är ett av de typiska exempel på heterotropisk till genetisk nivå.
Toostalregleringen av detta system är inte relaterad till förmågan att omvandla ett underlag till en produkt, utan till affiniteten för förening av ett protein till det operativa DNA -regionen.
Referenser
- Changeux, J. P., & Edelstein, s. J. (2005). Allosteriska mekanismer för signaltransduktion. Science, 308 (5727), 1424-1428.
- Guldbeter, a., & Dupont, g. (1990). Allosterisk reglering, samarbets- och biokemiska svängningar. Biophysical Chemistry, 37 (1-3), 341-353.
- Jiao, W., & Parker, och. J. (2012). Använda en kompination av beräkning och experimentella tekniker för att förstå molekylär bas för proteinallosteri. I framsteg inom proteinkemi och strukturell biologi (Vol. 87, sid. 391-413). Akademisk press.
- Kern, D., & Zuiderweg, och. R. (2003). Dynamikens roll i allosterisk reglering. Aktuell åsikt i strukturell biologi, 13 (6), 748-757.
- Laskowski, r. TILL., Gerick, f., & Thornton, J. M. (2009). Den strukturella grunden för allosterisk reglering i proteiner. FEBS Letters, 583 (11), 1692-1698.
- Mathews, C. K., Van Holde, K. OCH., & Ahern, K. G. (2000). Biochemistry, ed. San Francisco, Calif.
- « Kolananorörstruktur, egenskaper, applikationer, toxicitet
- Adaptiv strålningsprocess, typer och exempel »

