Antimonhistoria, struktur, egenskaper, användningar och risker

- 1286
- 277
- Anders Larsson
han antimon Det är en glansig, silvermetalloid och med en viss blå nyans. Dess fasta kännetecknas också av att vara väldigt spröd och av skivepitel. Det tillhör grupp 15 i det periodiska tabellen, leds av kväve. Efter vismuten (och moskuset) är det det tyngsta elementet i gruppen.
Det representeras av SB -kemiska symbolen. I naturen finns det huvudsakligen i stabit- och ullmannitiska mineraler, vars kemiska formler är SB2S3 respektive NISBS. Dess höga tendens att bilda sulfider istället för oxider beror på att den är kemiskt mjuk.
 Kristallin. Källa: Bästa sci-fatcs [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Kristallin. Källa: Bästa sci-fatcs [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Å andra sidan är antimon också fysiskt mjuk och presenterar en hårdhet på 3 på Mohs -skalan. Den är stabil vid rumstemperatur och reagerar inte med luftsyre. Men när han värms upp i närvaro av syre, bildar han antimontrioxiden, SB2ANTINGEN3.
Det är också resistent mot verkan av svaga syror; Men heta attackeras av kväve- och saltsyror.
Antimon har många tillämpningar, bland dem används i legeringar med bly och tenn, vid tillverkning av batterier för fordon, låg friktionsmaterial etc.
Denna metalloid har det sällsynta ägda för att öka volymen när den stelnades, vilket gör att dess legeringar helt kan ockupera det utrymme som används för att forma instrumentet som önskas att tillverka.
[TOC]
Historik om din upptäckt
före Kristus
Det finns bevis på att från 3100 till.C, antimonsulfid användes som kosmetik i Egypten. I Mesopotamia, nuvarande Irak, kvarstår kvar av en vas och en annan artefakt som påstås vara mellan de 3000 och 2200 åren till.C, där den användes i dess antimonutarbetande.
Introduktion av termen
Roman Erondito Plinio El Viejo (23-79 D.c) beskrev användningen av antimon, som han kallade Estibio, i utarbetandet av sju läkemedel i hans naturhistoriska fördrag. Alchemist Abu Mussa Jahir Ibn Hayyan (721-815) tillskrivs införandet av termen antimon för att utse elementet.
Han använde följande etymologi: 'anti' som en synonym för förnekande och 'mono' för bara för. Då ville han betona att antimon inte var ensam i naturen. Det är redan känt att det är en del av svavelmineraler, som gillar andra element.
Erhållande
Grekisk naturist Pedanius diakorider tros få ren antimon genom att värma antimonulfid i en luftström. Den italienska metallurgiska Vannocio Biringucio, i Pyrotechnics Book (1540), gör en beskrivning av en metod för att isolera antimon.
Den tyska kemisten Andreas Libavius (1615), genom användning av en gjuten blandning av järn, antimon sulfid, salt och kaliumtartrati, uppnådde produktionen av en kristallin antimon.
Den första detaljerade rapporten om antimon gjordes 1707 av den franska kemisten Nicolas Lemery (1645-1715), i sin bok behandlad på antimon.
Kan tjäna dig: kopparklorid (I) (CUCL): struktur, egenskaper, användningarAntimonstruktur
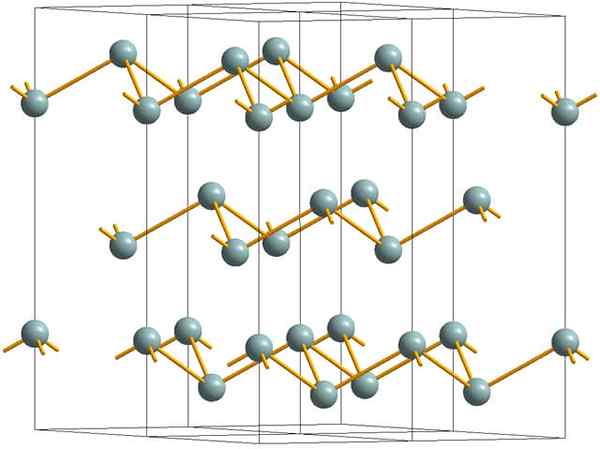 Rynkiga lager som utgör den kristallina strukturen i metallisk eller silverantimon. Källa: MaterialScientist [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Rynkiga lager som utgör den kristallina strukturen i metallisk eller silverantimon. Källa: MaterialScientist [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Den övre bilden visar strukturen för skrynkliga skikt som antagits av arsenikatomer. Gråaktig antimon, bättre känd som metallisk antimon, antar emellertid också denna struktur. Det sägs att det är "skrynkligt" eftersom det finns SB -atomer som stiger och faller från planet som består av skiktet.
Dessa lager, även om de är ansvariga för de fotoner som interagerar med det för att lysa silverglitter, vilket gör antimon som en metall, är sanningen att krafterna som förenar dem är svaga; Härifrån till de uppenbara metallfragmenten av SB kan lätt visas och är spröda eller sneakers.
Dessutom räcker inte SB -atomer i skrynkliga lager för att gruppera sina atomorbitaler och därmed skapa ett band som möjliggör elektrisk ledning.
När du ser en gråaktig sfär individuellt kan du se att den har tre SB-SB-länkar. Från ett högre plan kunde SB ses i mitten av en triangel, med tre SB belägna vid dess vertikaler. Triangeln är dock inte platt och har två nivåer eller golv.
Lateral reproduktion av sådana trianglar och deras länkar etablerar skrynkliga lager, som är inriktade på att bilda rhomboébiska kristaller.
Allotropi
Den nyligen beskrivna strukturen motsvarar det gråaktiga antimon, den mest stabila av dess fyra alotroper. De andra tre alotroperna (svart, gult och explosiva) är metastabla; det vill säga de kan existera under mycket rigorösa förhållanden.
Det finns inte för mycket information om dess strukturer. Det är emellertid känt att den svarta antimon är amorf, så att dess struktur är rörig och komplicerad.
Den gula antimon är stabil under -90 ° C, den uppträder som ett icke -metalliskt element och kan antas som består av små SB -agglomerat4 (liknande fosfor); När den uppvärms förvandlas den till den svarta alotropen.
Och med avseende på det explosiva antimonet består det av en gelatinös tank bildad på katoden under elektrolysen av en vattenlösning av en antimonhalogenid.
Till den minsta starka RUBB.
Egenskaper
Atomvikt
121,76 g/mol.
Atomnummer
51.
Elektronisk konfiguration
[KR] 4d105S25 p3.
Oxidationstillstånd
-3, -2, -1, +1, +2, +3, +4, +5.
Fysisk beskrivning
Glansigt silver, spröd, skivepitel, med en blå nyans. Det kan också visas som ett svart damm.
Smältpunkt
630,63 ºC.
Kokpunkt
1.635 ºC.
Densitet
-6 697 g/cm3 vid rumstemperatur.
-6.53 g/cm3 I flytande tillstånd, temperatur lika med eller högre till smältpunkten.
Fusionsvärme
19,79 kJ/mol.
Förångningsvärme
193,43 kJ/mol.
Kan tjäna dig: kopparsulfid: struktur, egenskaper, användningarMolorisk kapacitet
25.23 J/mol.K
Elektronnegativitet
2.05 (Pauling Scale).
Atomradio
140.
Hårdhet
Det är ett mjukt element med en hårdhet på 3 på Mohs -skalan och kan repas med glas.
Stabilitet
Det är stabilt vid rumstemperatur, och inte upplever oxidation. Det är också resistent mot syraattack.
Isotoper
Den har två stabila isotoper: 121SB och 123Sb. Dessutom finns det 35 radioaktiva isotoper. Den radioaktiva isotopen 125SB är den med den största halvlivet: 2,75 år. I allmänhet avger radioaktiva isotoper ß -strålning+ och β-.
Elektrisk och värmeledningsförmåga
Antimon är en dålig ledare av värme och el.
Kemisk reaktivitet
Kan inte förskjuta väte från utspädda syror. Jonisk komplex form med organiska och oorganiska syror. Det metalliska antimonet reagerar inte med luften, men den omvandlas snabbt till oxid till den våta luften.
Halogener och sulfider oxiderar lätt antimon, om processen inträffar vid höga temperaturer.
Ansökningar
Legeringar
Antimon används i legering med bly för utarbetande av plattor för bilbatterier, vilket förbättrar plattorna, liksom egenskaperna hos belastningarna.
Bly- och tennlegering har använts för att förbättra svetsarnas egenskaper, liksom för spårkulorna och patronerna. Det används också i legeringar för elektrisk kabelbeläggning.
Antimon används i antifrictionslegeringar, i beredningen av skal- och härdningslegeringar med lågt tenninnehåll i tillverkningen av organ och andra musikinstrument.
Den presenterar karakteristiken, delad med vattnet, med ökande volym när den kondenseras; Så den antimon som finns i legeringar med bly och tenn, fyller alla mögelutrymmen och förbättrar definitionen av strukturerna med dessa legeringar.
Brandskyddsmedel
Antimontrioxid används för utarbetande av ignifedföreningar, alltid i kombination med halogenerade brandhämmande medel, bromuros och klorid.
Brandhanterare kan reagera med syre- och radikala atomer oh, som hämmar eld. Dessa ignifed används i kläder för barn, leksaker, flygplan och i bilstolar.
De läggs också till i polyesterhartser och i glasfiberkomposser för begagnade föremål som lätta flygmotorer täcker.
Antimonföreningar som används som brandhämmande inkluderar: antimonoxyklorid, SBOCL; antimonpentoxid, SBO5; Antimon triklorid, SBCL3; och antimontrioxid, SBO3.
Elektronikfält
Det används vid tillverkning av halvledare, dioder, medelinfraröda detektorer och i utarbetandet av transitorer. Antimon med hög renhet, som används i halvledarteknologi, erhålls genom reduktion av antimonföreningar med väte.
Kan tjäna dig: Faktorer som påverkar löslighetenMedicin och veterinär
Antimonföreningar har använts i medicin sedan forntida tider som eméticas och antiprotozoa. Kalium kaliumtartrati (estetik tartar) användes som en antisquisosomal under lång tid; Används också som slempektor, diaphoretic och emético.
Antimonsalter har också använts i konditioneringen av huden hos idisslare. såsom aniomalin och litium- och antimon -tiomalat.
Meglumin Antimon är ett läkemedel som används vid behandling av leishmaniasis i externa strålkastare hos husdjur. Även om de terapeutiska fördelarna var knappa.
Pigment och målningar
Antimonföreningar används vid utarbetande av färger och opacifier i emaljer. De används också i Bermellón, gula och orange pigment, som är produkter av långsam oxidation av antimonulfider.
Några av dess organiska salter (Tartratos) används i textilindustrin för att hjälpa till i länken till vissa färgämnen.
Antimon sulfid användes i det forna Egypten som kosmetik i ögonen mörkare.
Andra användningsområden
Vissa antimonsalter används som beläggningsmedel för att eliminera mikroskopiska bubblor som bildas på tv -skärmar. Antimonjoner interagerar med syre, vilket eliminerar deras tendens att bilda bubblor.
Antimon sulfid (III) används i huvuden på vissa säkerhetsmatchningar. Antimonulfid används också vid stabiliseringen av friktionskoefficienten för materialen som används i bilbromsbelägg.
Isotopen 124SB, tillsammans med beryllium, används som en källa till neutroner, med ett energigenomsnitt på 24 keV. Dessutom används antimon som en katalysator i plastproduktion.
Risker
Det är ett sprött element, så att ett föroreningspulver i miljön kan uppstå under manipulation. Hos arbetare som utsätts för antimondamm, dermatit, renit, inflammation i hög luftvägar och konjunktivit har observerats.
Pneumokonios har beskrivits, ibland i kombination med obstruktiva lungförändringar, efter långvariga utställningar.
Antimontrioxid kan orsaka skador på hjärtfunktion som kan vara dödlig.
Hos personer som utsätts för detta element har närvaron av pustulära hudinfektioner observerats av en övergående natur.
Kontinuerlig låg dosintag av denna metall kan orsaka diarré kräkningar och magsår. Dessutom är den maximala tolererbara koncentrationen i luften 0,5 mg/m3.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Manny. (11 mars 2009). Gul antimon och explosiv antimon. Hämtad från: AntimonyProperties.Bloggfläck.com
- Prof. Ernst Cohen och J. C. Van den Bosch. (1914). Antimonens allotropi. Förfaranden Royal Acad. amsterdam. Vul. Xvii.
- Wikipedia. (2019). Antimon. Hämtad från: i.Wikipedia.org
- AVAMEG, INC. (2019). Antimon. Återhämtat sig från: kemi.com
- Mc'oneal sabel. (15 september 2018). Kemi: Egenskaper och tillämpning av SB-antimony. Återhämtat sig från: medium.com
- « Biogeografihistoria, vilka studier och forskningsexempel
- Hörselföroreningar orsaker, konsekvenser, lösningar »

