Svavelhistoria, egenskaper, struktur, erhållning, användning

- 2066
- 395
- Lars Eriksson
han svavel Det är ett icke -metalliskt element som leder, under syre, gruppen av calcogener i det periodiska tabellen. Det är specifikt beläget i grupp 16 med period 3 och representeras med den kemiska symbolen. Av dess naturliga isotoper, 32S sover mycket (cirka 94% av alla svavelatomer).
Det är ett av de vanligaste elementen på jorden och komponerar cirka 3% av dess totala massa. Det vill säga att om alla svavel på planeten togs, kunde två gula månar byggas; det skulle finnas tre satelliter istället för en. Det kan anta flera oxidationstillstånd (+2, -2, +4 och +6), så deras salter är många och berikar markbarken och kärnan.
 Svavelkristaller. Källa: Pixabay.
Svavelkristaller. Källa: Pixabay. Svavel är synonymt med gula, dåliga lukt och helvete. Det främsta skälet till dess dåliga lukt beror på dess härledda föreningar; särskilt gasformigt och organiskt. Av resten är deras mineraler solida och har färger som inkluderar gult, grått, svartvitt (bland andra).
Det är ett av de element som de flesta presenterar ett brett antal alotroper. Det kan hittas som små och diskrala molekyler av s2 eller s3; som ringar eller cykler, att vara ortorrombiska och monokliniska svavel8 den mest stabila och rikliga av alla; Och som spiralformade kedjor.
Det finns inte bara i landbarken i form av mineraler, utan också i de biologiska matriserna i våra kroppar. Till exempel är det i cystin-, cystein- och metioninaminosyror, i järn-, keratin- och vitaminproteiner. Det finns också i vitlök, grapefrukt, lök, kål, broccoli och cauliflor.
Kemiskt är det ett mjukt element, och i frånvaro av syreform av svavelmineraler och sulfater. Brännskador med en blåaktig låga och kan visas som ett amorft eller kristallint fast ämne.
Trots att den är oundgänglig för syntesen av svavelsyra, mycket frätande substans och tilldelande obehaglig lukt, är det faktiskt ett godartat element. Svavel kan förvaras i alla utrymmen utan större försiktighetsåtgärder, så länge bränder undviks.
[TOC]
Svavelhistoria
I Bibeln
Svavel är ett av de äldsta elementen i mänsklighetens historia; Så mycket att hans upptäckt är osäker och det är inte känt vilken av de forntida civilisationerna som använde den för första gången (4000 år före Kristus). På samma sidor i Bibeln kan du hitta den som följer med den infernala elden och nedbrytningarna.
Det tros att den påstådda lukten av helvetet har att göra med vulkanutbrott. Hans första upptäckare hade säkert att stöta på gruvor av detta element som dammland eller gula kristaller i närheten av en vulkan.
Antikvitet
Detta gulaktiga fasta material visade snart anmärkningsvärda läkningseffekter. Till exempel använde egypterna svavel för att behandla ögonlockens inflammationer. Det lindrade också skabb och akne, en applikation som idag kan ses i svavel tvålar och andra dermatologiska föremål.
Romarna använde detta element i sina ritualer, till exempel fumigante och blekning. När librara sos2, Gas som översvämmade rummen som blandades med fukt och tillhandahöll ett antibakteriellt medium och kan förintas insekter.
Romarna, som grekerna, upptäckte svavelens höga brännbarhet, så det blev synonymt med eld. Färgen på hans blåiga lågor var tvungen att belysa de romerska cirkuserna. Det tros att grekerna under tiden använde detta element för att skapa brännvapen.
Kineserna på deras sida lärde sig att blanda svavel med saltpeter (KNO3) och kol skapade den svarta krutt som betalade en historisk omsättning, och som väckte i nationerna av då stora krav och intresse för detta mineral.
Det kan tjäna dig: cirkonium: historia, egenskaper, struktur, risker, användningarModerna tider
Som om krutt inte var en tillräcklig anledning att begära svavel, svavelsyra och industriella tillämpningar kom snart fram. Och med svavelsyravanden mättes mängden rikedom eller välstånd i ett land i förhållande till dess konsumtionsnivåer för denna förening.
Det var inte förrän 1789 när den lysande kemisten Antoine Lavoisier kunde känna igen svavel och klassificera det som ett element. Sedan 1823 upptäckte den tyska kemisten Eilhard Mitscherlich att svavel främst kan kristallisera på två sätt: Rhomboédrica och monoclinic.
Svavelhistorien följde samma kanal för dess föreningar och tillämpningar. Med den enorma industriella betydelsen av svavelsyra åtföljde han vulkaniseringen av gummi, syntesen av penicillin, gruvutnyttjande, raffinering av svavel -rika oljor, jordnäring, etc.
Egenskaper
Fysiskt utseende
Bris fast i damm eller kristaller. Dess färg är ogenomskinlig citrongul, den är smaklös och saknar lukt.
Flytande utseende
Flytande svavel är singular eftersom dess initiala gula färg blir rödaktig och intensifieras och mörknar om den genomgår höga temperaturer. När det brinner, säg blå och ljusa lågor.
Molmassa
32 g/mol.
Smältpunkt
115.21ºC.
Kokpunkt
445ºC.
antändningspunkt
160ºC.
Självtemperatur
232ºC.
Densitet
2,1 g/ml. Men andra alotroper kan vara mindre täta.
Molvärmekapacitet
22,75 j/mol · k
Radiokovalent
105 ± 15:00.
Elektronnegativitet
2.58 på Pauling -skalan.
Polaritet
S-S-länkar är apolära eftersom båda svavelatomerna har samma elektronegativitet. Detta gör alla dess alotroper, cykliska eller i form av kedjor, vara apolär; Och därför är dess interaktioner med vatten ineffektiva och kan inte solubiliseras i den.
Svavel kan emellertid lösas i apolära lösningsmedel såsom koldisulfid, CS2, och aromatisk (bensen, toluen, xylen, etc.).
Joner
Svavel kan bilda flera joner, i allmänhet anjoner. Den mest kända av allt är sulfid, s2-. S2- Det kännetecknas av att vara skrymmande och en mjuk bas av Lewis.
För att vara en mjuk bas konstaterar teorin att den tenderar att bilda föreningar med mjuka syror; Som övergångsmetallkatjoner, inklusive tro2+, Pb2+ och cu2+.
Elektronisk struktur och konfiguration
Svavelkronan
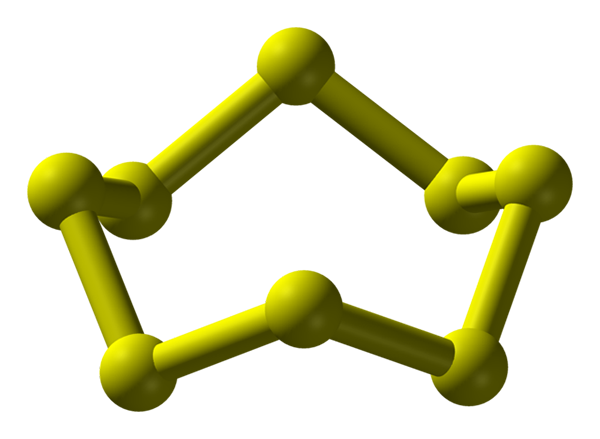 S8 -molekyl, den mest stabila och rikliga alotropiken av svavel. Källa: Benjah-Bmm27.
S8 -molekyl, den mest stabila och rikliga alotropiken av svavel. Källa: Benjah-Bmm27. Svavel kan förekomma i en mängd olika alotroper; och dessa i sin tur har kristallina strukturer som modifieras under olika tryck och/eller temperaturer. Därför är svavel ett rikt element i alotropos och polymorfer, och studien av dess fasta strukturer representerar en oändlig källa till teoretiska experimentella verk.
Varför en sådan strukturell komplexitet? Till att börja med är kovalenta bindningar i svavel (S-S) mycket starka och övervinnas endast av kol, C-C och av väte, H-H.
Svavel, till skillnad från kol, tenderar inte att bilda tetrahedra utan boomerangs; att de med sina vinklar fälls och ringer för att stabilisera svavelkedjor. Den mest kända ringen av alla, som också representerar svavelens mest stabila alotropiska8, "Svavelkronan" (högre bild).
Observera att alla S-S-länkar8 De verkar individuella boomerangs, vilket resulterar i en ring med veck och platt alls. Dessa kronor s8 De interagerar genom London -styrkor, orienterade på ett sådant sätt att de lyckas skapa strukturella mönster som definierar en ortorrombisk kristall; kallas s8 α (S-a, eller helt enkelt ortorrombisk svavel).
Kan tjäna dig: elastiska materialPolymorfer
Svavelkronan är en av de många alotroperna för detta element. S8 a är en polymorf av denna krona. Det finns två andra (bland de viktigaste) som kallas s8 β och s8 y (S-p respektive S-y). Båda polymorferna kristalliseras i monokliniska strukturer och är s8 y är tätare (svavelgamma).
De tre är gula fasta ämnen. Men hur erhålls varje polymorf separat?
S8 ß förbereder s8 a vid 93 ° C, vilket sedan tillåter dess långsamma kylning för att bromsa återgången till den ortorrombiska fasen (a). Och s8 y, å andra sidan, erhålls när det är baserat8 a vid 150 ° C, vilket gör att det kan svalna långsamt; Det är den tätaste av svavelkrona polymorfer.
Andra cykliska alotroper
Kronan s8 Det är inte den enda cykliska alotropen. Det finns andra som S4, S5 (Analog till cyklopentano), s6 (representerad av en hexagon såväl som cykeln), s7, S9, och s10-20; Det senare innebär att det kan finnas ringar eller cykler som innehåller från tio till tjugo svavelatomer.
Var och en av dem representerar olika svavelcykliska alotrochs; Och i sin tur, för att betona det, har de varianter av polymorfer eller polymorfa strukturer som beror på tryck och temperatur.
Till exempel s7 Den har upp till fyra kända polymorfer: α, β, y och Δ. Medlemmarna eller kronorna med högre molekylmassor är organiska syntesprodukter och dominerar inte i naturen.
Svavelkedjor
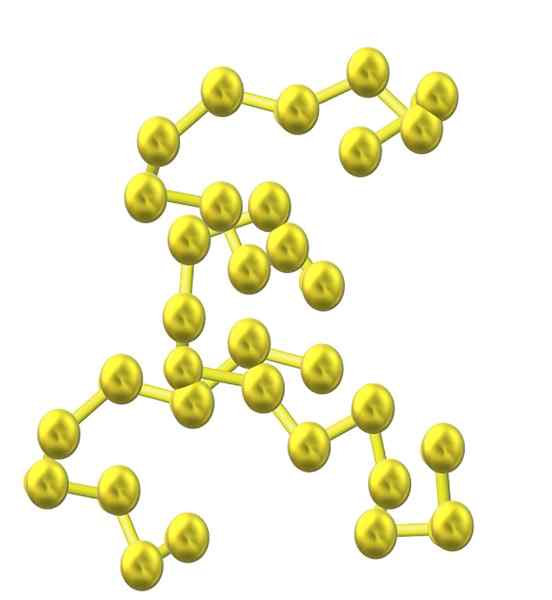 Svavelkedja. Källa: Opentax [CC av 4.0 (https: // CreativeCommons.Org/licenser/av/4.0)]
Svavelkedja. Källa: Opentax [CC av 4.0 (https: // CreativeCommons.Org/licenser/av/4.0)] När fler svavelatomer är införlivade i strukturen, minskar deras tendens att ringa och svavelkedjor förblir öppna och anta spiralformade konformationer (som om de var spiraler eller skruvar).
Och därmed uppstår en annan voluminös familj av svavelalotrops som inte består av ringar eller cykler utan av kedjor (som den överlägsna bilden).
När dessa S-S-kedjor anpassas parallellt med glaset, fångar de föroreningar och slutar definiera ett fibröst fast ämne som kallas fibrös svavel, eller S-ψ. Om det finns kovalenta bindningar bland dessa parallella kedjor som sammankopplar dem (som med vulkaniseringen av gummi), har vi laminärt svavel.
När svavel är8 Det smälter en gulaktig flytande fas som kan bli mörk om temperaturen ökas. Detta beror på att S-S-länkar är trasiga och därför inträffar en termisk depolymerisationsprocess.
Denna vätska när det kyls visar plastegenskaper och sedan glasartat; det vill säga en glasvisk svavel och amorf (S-var) erhålls. Dess sammansättning består av både ringar och svavelkedjor.
Och när en blandning av den fibrösa och laminära alotropen erhålls från det amorfa svaveln, en kommersiell produkt som används för vulkanisering av gummi.
Små alotroper
Även om de är kvar sist är de inte mindre viktiga (eller intressanta) än alotropos för de största molekylmassorna. S2 och s3 är de svaveliserade versionerna av o2 Jag3. I de två första svavelatomerna går de med en dubbelbindning, S = S, och i den andra finns det tre atomer med resonansstrukturer, S = S-S.
Båda s2 som s3 De är gasformiga. S3 Manifestera en körsbärsröd färg. De två har tillräckligt med bibliografiskt material till varje täckning av en enskild artikel.
Elektronisk konfiguration
Den elektroniska konfigurationen för svavelatomen är:
[NE] 3S2 3p4
Du kan tjäna två elektroner för att slutföra din okteto av Valencia och därmed ha ett oxidationstillstånd på -2. På samma sätt kan du förlora elektroner, börja med två i sina 3P -orbitaler, vara dess oxidationstillstånd på +2; Om du tappar ytterligare två elektroner, med dina tomma 3P -orbitaler, kommer din oxidationsstatus att vara +4; Och om du tappar alla elektroner kommer det att vara +6.
Kan tjäna dig: metalloiderErhålla var är svavel?
Mineralogisk
Svavel är en del av många mineraler. Bland dem är pyriten (FES2), La Galena (PBS), Covellita (CUS) och andra sulfat- och sulfider mineraler. Genom att bearbeta dem kan inte bara metaller extraheras, utan också svavel efter en serie reduktiva reaktioner.
Det kan också erhållas rent i vulkaniska ventiler, där när temperaturen höjs och spill nedförsbacke; Och om han sätter sig i eld kommer han att se ut som en blåaktig lava. Genom svårt arbete och ansträngande fysiska verk kan svavel samlas in eftersom det gjordes ganska ofta på Sicilien.
Svavel kan också hittas i underjordiska gruvor, som är gjorda för att pumpa överhettning av vatten för att smälta och överföra det till ytan. Denna erhållningsprocess kallas Brasch -processen, för närvarande lite använt.
Petroleum
Idag kommer det mesta av svavelet från oljeindustrin, eftersom dess organiska föreningar är en del av sammansättningen av olje -råolja och dess raffinerade derivat.
Om en förfinad råolja eller produkt är rik på svavel och genomgår hydrodesulfurisering kommer den att släppa stora mängder H2S (stinkig gas som luktar som ruttna ägg):
R-r + 2 h2 → 2 RH + H2S
Sedan h2S Det är kemiskt i Clauss -processen, sammanfattad med följande kemiska ekvationer:
3 o2 + 2 h2S → 2 Så2 + 2 h2ANTINGEN
Sw2 + 2 h2S → 3 s + 2 h2ANTINGEN
Ansökningar
Några av användningarna för svavel nämns nedan och i allmänhet:
- Det är ett väsentligt element för både växter och djur. Det är till och med närvarande i två aminosyror: cystein och metodin.
- Det är råmaterialet för svavelsyra, sammansatt vid beredningen av otaliga kommersiella produkter.
- I läkemedelsindustrin är den avsedd för syntes av svavelderivat, och penicillinet är det mest kända av exemplen.
- Tillåter vulkanisering av gummi genom att sammankoppla polymerkedjor med S-S-länkar.
- Dess gula färg och blandningar med andra metaller gör det önskvärt inom pigmentindustrin.
- Blandat med en oorganisk matris, såsom sand och stenar, betong och svavelasfalt är beredd på ersättningen av bitumen.
Risker och försiktighetsåtgärder
Svavel på egen hand är ett ofarligt, icke -toxiskt ämne och representerar också potentiella risker, såvida inte reagerar för att bilda andra föreningar. Dess sulfatsalter är inte farliga och kan manipuleras utan större försiktighetsåtgärder. Detta händer emellertid inte med dess gasformiga derivat: så2 och h2S, båda extremt giftiga.
Om det är i en flytande fas kan det orsaka allvarliga brännskador. Om det är uppslukande i stora mängder kan H trigger2S i tarmen. För resten representerar det ingen risk för dem som tuggar.
I allmänna termer är svavel ett säkert element som inte kräver för många försiktighetsåtgärder, förutom att hålla det borta från eld och starka oxiderande medel.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Laura Crapanzano. (2006). Svavelpolymorfism: strukturella och dynamiska aspekter. Fysik [fysik].University Joseph -Fourier - Grenoble i. engelsk. Fftel-00204149f
- Wikipedia. (2019). Svavel. Hämtad från: i.Wikipedia.org
- Meyer Beat. (1976). Elementär svavel. Kemiska recensioner, volym. 76, nej. 3.
- Doktor. Doug Stewart. (2019). Svavelelement fakta. Kemikkolis. Återhämtat sig från: Chemicool.com
- Donald W. Davis och Randall a. Detro. (2015). Svavelhistoria. Georgia Gulf Sulphur Corporation. Återställt från: Georgiagulfsulfur.com
- Helmestine, Anne Marie, PH.D. (11 januari 2019). 10 intressanta svavelfakta. Återhämtat sig från: tankco.com
- Boone, C.; Bond, c.; Hallman, a.; Jenkins, j. (2017). Allmänt svavelfaktablad; National Pesticide Information Center, Oregon State University Extension Services. Npic.Orst.Edu
- « Oberoende från Mexiko orsaker, utveckling, konsekvenser, karaktärer
- Flora och fauna av Jalisco representativa arter »

