Bensaldehyd
- 1223
- 236
- Hans Olsson
Vi förklarar vad bensaldehyd, dess fysiska och kemiska egenskaper, kemisk struktur, tillämpningar och syntes är
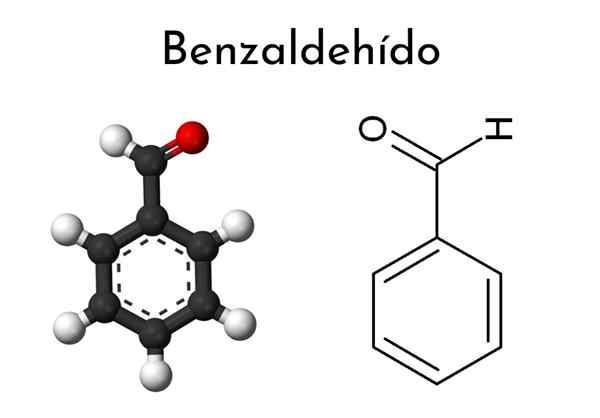 Kemisk struktur av bensaldehyd
Kemisk struktur av bensaldehyd Vad är bensaldehyd?
han Bensaldehyd Det är en organisk förening vars kemiska formel är c6H5Cho. Vid rumstemperatur är det en färglös vätska som kan bli gulaktig med förvaring. Representerar den enklaste aromatiska aldehyden och den mest använda industriellt. I detta är Formil -gruppen länkad direkt till bensenringen.
Det finns naturligtvis i cortex av stjälkar, blad och frön av växter, till exempel: mandel, körsbär, persika och äpple. Det finns också i oljemandeloljor, patchulí, jacinto och cananga. Benzaldehyd kan absorberas av huden och lungorna, men metaboliseras snabbt till bensoesyra.
Detta kombineras med glukuronsyra eller glycin och utsöndras i urinen. Det används som en smaksättning av vissa livsmedel, i parfymindustrin och inom läkemedelsindustrin. Dess största betydelse är att från bensaldehyd föreningar såsom bensylsyra, cyninsyra, mandelisk syra, etc.
De tidigare utsedda föreningarna har många användningsområden. Benzaldehyd är också ett inkompatibelt bränsle med starka oxiderande medel, starka syror och reducerande medel och ljus.
Benzaldehyd fysiska och kemiska egenskaper
Kemiska namn
Bensaldehyd, bensoisk, bensenokarbonal, fenylmetanal och bensenokarboxaldehyd aldehyd.
Molekylär formel
C7H6O o c6H5Cho
Färg
Det är en färglös vätska som kan bli gulaktig.
Lukt
Liknar den för bitter mandel.
Smak
Brinnande aromatisk.
Kokpunkt
- 354 ºF vid 760 mmHg.
- 178,7 ºC.
Fusionspunkt
- 15 ºF.
- 26 ºC.
Löslighet
- I vatten, 6 950 mg/L vid 25 ° C, eftersom det är en övervägande apolär förening och interagerar svagt med vattenmolekyler.
- Belopp med alkohol, eter, fasta och flyktiga oljor.
- Löslig i flytande ammonium, apolärt lösningsmedel.
Densitet
- 1 046 g/cm3 vid 68 ºF.
- 1 050 g/cm3 vid 15 ºC.
- Dess ånga är tätare än luft: 3,65 gånger i förhållande till detta.
Stabilitet
Det är stabilt vid rumstemperatur. Oxiderad i luften till bensoesyra.
Gegga
1 321 CP vid 25 ° C
Strukturera
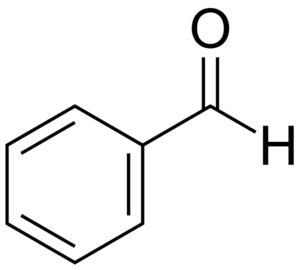
Som framgår av den första bilden, strukturen på bensaldehyden. Så bensaldehyd är en organisk, aromatisk och polär förening.
Vad är dess molekylgeometri? Eftersom alla kolatomer som utgör bensenringen har SP2 -hybridisering, liksom den för formylgruppen, vilar molekylen på samma plan, och följaktligen kan den visualiseras som en fyrkant (eller rektangel, ses axiellt).
Intermolekylär interaktioner
Formil -gruppen etablerar ett permanent dipolmoment i bensaldehydmolekylen, även om den är anmärkningsvärt svag jämfört med bensoesyra.
Detta gör att du kan ha starkare intermolekylära interaktioner än bensen, vars molekyler bara kan interagera genom London-styrkor (inducerade dipol-dipol-dipare).
Ovanstående återspeglas i dess fysiska egenskaper, såsom kokpunkten, som är två gånger överlägsen än Benzene (80 ºC).
Dessutom saknar formilgruppen förmågan att bilda vätebroar (väte är kopplad till kol, inte med syre). Detta gör det omöjligt för bensaldehydmolekyler att bilda tre dimensionella arrangemang, såsom de som observerats i bensoesyrakristaller.
Användning/applikationer
Tillsatsmedel och aromatiserande och smakämnen
Det är en förening som fungerar som en bas för läkemedel, färgämnen, parfymer och i hartsindustrin. Det kan också användas som lösningsmedel, mjukgörare och smörjmedel för låga temperaturer. Det används för att aromatisera eller krydda mat och tobak.
Det kan tjäna dig: kaliumdikromat: formel, egenskaper, risker och användningarDet används vid beredning av smaker, som mandel, körsbär och mutter. Det används också som ett aromatiserande medel i konserverad körsbärssirap. Det ingriper i utarbetandet av intervall av violet, jasmin, akacia, solros, etc., och används i tvåltillverkning. Det används som bränsle- och bränsleadditiv.
Okonventionella applikationer
Det ingriper som ett reagens i bestämningen av ozon, fenol, alkaloider och metylen. Det fungerar som en mellanhand av regleringen av växttillväxt.
Benzaldehyd och N-heptaldehyd hämmar snökristallisation, och undviker bildandet av djupa isavlagringar, orsakar snöalms. Denna användning invändas emellertid eftersom det är en källa till miljöföroreningar.
Frånstötande
Benzaldehyd används som ett avvisande bin, som använder i bikuporna i samband med röken för att flytta bort bikupan och för att kunna arbeta utan risk i dessa, undvika bitarna.
I syntesen av malakiten
Malachite Green är en sammansatt syntetiserad med intervention av bensaldehyd. Färgämnet används i fiskodling för att bekämpa fisksjukdomar, till exempel bekanta med vita punkter och svampinfektioner.
Det kan endast användas i akvarier, eftersom skadliga effekter på däggdjur har rapporterats, bland vilka cancerframkallande, mutagenes, teratogenes och kromosomal fakturering; Det är därför användningen har varit förbjuden i många länder.
Det används också i mikrobiologi för färgning av bakteriella sporer.
Syntetisk mellanhand
- Benzaldehyd är mellanhand i syntesen av kinaminsyran som används i kryddor, men dess huvudanvändning är att erhålla metyl-, etyl- och bensylestrar som används i parfymerindustrin. Cinamic Acid inducerar cytastas och reversering av maligna egenskaper hos humana humana tumörceller In vitro.
- Benzaldehyd ingriper i syntesen av bensylalkohol, som även om den används som en matkryddor och industriell lösningsmedel, är dess huvudfunktion att tjäna som en mellanhand för syntes av föreningar som används i läkemedelsindustrin och produktion av parfymer, kryddor och vissa anilin färgämnen.
- Benzaldehyd är en mellanhand i syntesen av mandelsyra. Detta används vid behandling av hudproblem, såsom åldrande på grund av exponering för solljus, oregelbunden pigmentering och akne.
- Det har antibakteriell användning som fungerar som ett oralt antibiotikum vid urinvägsinfektioner.
Syntes
Den mest använda formen av bensaldehydsyntes är genom Toluenes katalytiska oxidation, med manganoxidkatalysatorer (MNO2) och koboltoxid (COO). Båda reaktionerna utförs med svavelsyra som ett medel.

