Beta galaktosidasegenskaper, struktur, funktioner
- 2823
- 846
- Karl Johansson
De Beta -galaktosidas, Även kallat p-galaktosidas- eller p-D-galaktohydrolys är ett enzym som tillhör familjen av glykosilhydrolaser som kan hydrolysera galaktosylavfall av olika typer av molekyler: polymerer, oligosackarider och sekundära metaboliter, bland annat.
Tidigare känd som "laktas" är dess distribution, liksom den för oligo- och p-galaktositetspolysackarider som fungerar som substrat, extremt bred. Det finns i bakterier, svampar och jäst; I växter är det vanligt i mandlar, persikor, aprikos och äpplen, och hos djur finns det i organ som mage och tarmar.
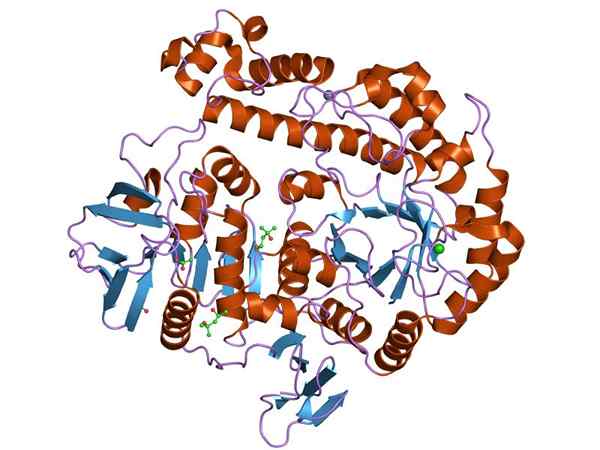
 Grafisk representation av strukturen för B-galaktosidasenzymet (källa: Jawahar Swaminathan och MSD-personal vid European Bioinformatics Institute [Public Domain] via Wikimedia Commons)
Grafisk representation av strukturen för B-galaktosidasenzymet (källa: Jawahar Swaminathan och MSD-personal vid European Bioinformatics Institute [Public Domain] via Wikimedia Commons) Det mest studerade enzymet är Opeon Lak av OCH. coli, Gen kodad Lacz, vars studier har varit nyckeln till att förstå funktionen av genetiska operationer och många reglerande aspekter av dem.
Det tillhör för närvarande den bästa -studerade enzymgruppen och deras mest kända funktion är hydrolysen av de glukosidiska länkarna för laktos. Det uppfyller väsentliga metaboliska funktioner i organismerna som uttrycker det och används också med olika industriella ändamål.
Bland industriella tillämpningar är avlägsnande av laktos av mejeriprodukter för laktosintoleranta människor och produktion av flera galaktositetsföreningar. De används också för att förbättra sötma, smak och matsmältning av många mejeriprodukter.
[TOC]
Egenskaper
Förutom galaktositetssubstrat såsom laktos, kräver de flesta av kända ß-galaktosidaser divalenta metalljoner såsom magnesium och natrium. Detta har bevisats med upptäckten av fackliga platser för dessa metaller i dess struktur.
Ss-galaktosidor som finns i naturen har en stor variation av pH-intervall som de kan arbeta. Svampenzymer fungerar i syramiljöer (2.5 till 5.4), medan jäst och bakterier arbetar mellan 6 och 7 pH -enheter.
Kan tjäna dig: gram negativa bakterierp-galaktosidas bakteriell
Bakterier har stora galato-hydrolytiska enzymer jämfört med andra Galactosidas analyserade. I dessa organismer katalyserar samma enzym tre typer av enzymatiska reaktioner:
- Hydrolyza -laktos till dess konstitutiva monosackarider: galaktos och glukos.
- Katalyserar transgastilation av laktos till alolaktosen, ett disackaridsocker som deltar i den positiva regleringen av uttrycket av generna som tillhör opeonen Lak, Eopp.
- Hydrolyserar alolaktosen som liknar hur det gör med laktos.
p-galaktosidas svamp
Svampar har ß-galaktosidasenzymer som är mer mottagliga för galaktosinhibering än enzymer som tillhör andra organismer. Dessa är emellertid termostabla och fungerar inom syra pH -intervall.
Laktosmetabolism medierad av dessa enzymer i svampar är uppdelat i extracellulär och cytosolisk.
Strukturera
P-galaktosidasenzymet av bakterier är ett tetrameriskt enzym (av fyra identiska underenheter, A-D) och var och en av dess monomerer har mer än 1.000 aminosyravfall, vilket betyder en molekylvikt på mer än 100 kDa för varje och mer än 400 kDa för det komplexa proteinet.
I växter, tvärtom, är enzymet betydligt mindre storlek och kan vanligtvis hittas som en dimer av identiska underenheter.
Domänerna för varje monomer skiljer sig med siffrorna från 1 till 5. Domän 3 har en fatstruktur α/ß “TIM” och har den aktiva platsen vid C-terminalens ände.
Kan tjäna dig: djur- och växtorganogenes och dess egenskaperDet antas att de aktiva platserna i det enzymatiska komplexet delas mellan monomerer, så detta enzym är biologiskt aktivt endast när det är komplex som en tetrameter.
Dess aktiva plats har förmågan att gå med i d-glucosa och d-galaktos, de två monosackariderna som utgör laktos. Det är särskilt specifikt för D-galaktosen, men det är inte så mycket för glukos, så enzymet kan verka på andra galaktosider.
Funktioner
I djur
I tarmen hos människor har det huvudsakliga funktionen hos detta enzym att göra med absorptionen av laktos som intas med mat, eftersom det är beläget på luminalytan på plasmamembranet i tarmceller i form av en borstform.
Dessutom har det visats att de lysosomala isoformerna av detta enzym deltar i nedbrytningen av många glukolipider, mukopolysackarider och galaktositet glykoproteiner, som har flera syften på olika cellulära rutter.
I växter
Växter har ß-galaktosidasenzymer på blad och frön. Dessa uppfyller viktiga funktioner i katabolismen hos galaktolipiderna, som är karakteristiska för alger och växter i allmänhet.
I dessa organismer deltar p-galaktosidas i processerna för växttillväxt, mognad av frukt och i de övre växterna är detta det enda kända enzymet som kan hydrolysera galaktosylavfall från cellväggens galacositetspolysa.
I bransch och forskning
I livsmedelsindustrin relaterad till mejeriprodukter används p-galaktosidasenzymet för att katalysera hydrolysen av laktos som finns i mejeriprodukter, som är ansvarig för många av defekter som är relaterade till lagring av dessa produkter.
Hydrolysen av detta socker syftar till att undvika sedimentation av partiklar, kristallisationen av frysta mjölkdesserter och närvaron av "sandiga" strukturer i de flesta kommersiella derivat av mjölk.
Kan tjäna dig: Jordens livsmedelskedja: Länkar och exempelP-galaktosidaset som används industriellt erhålls, vanligtvis, från svampen Aspergillus sp., Även om enzymet producerat av jäst Kluyveromyces lactis Det används också allmänt.
P-galaktosidasaktiviteten, som översätter till vetenskapliga termer såsom ”laktosfermentering”, testas rutinmässigt för identifiering av Gram-negativa enterobakterier som finns i olika typer av prover.
Dessutom används det på medicinska termer för produktion av laktosfri mejeri och för formulering av tabletter som används av laktosintoleranta människor för att smälta mjölk och deras derivat (yoghurt, ost, glass, smör, krämer, etc.).
Det används som "biosensorer" eller "biomarkör" med mångfald av syften, från immunanalyser och toxikologisk analys till analys av genuttryck och diagnos av patologier tack vare den kemiska immobiliseringen av detta enzym i specialstöd i specialstöd.
Referenser
- Henrissat, b., & Daviest, g. (1997). Strukturell och sekvensbaserad klassificering av glykosidhydroler. Aktuell biologi, 7, 637-644.
- Huber, r. (2001). Beta (b) -galaktosidas. Akademisk press, 212-214.
- Husain, q. (2010). ß Galactosidaese och deras potentiella tillämpningar: en recension. Kritiska recensioner inom bioteknik, 30, 41-62.
- Domare, D. H., Matthews, b. W., & Huber, r. OCH. (2012). LACZ B-galaktosidas: struktur och funktion av ett enzym av historisk och molekylärbiologisk betydelse. Vetenskapsprotein, tjugoett, 1792-1807.
- Lee, b. OCH., Han, J. TILL., Im, J. S., Morrone, A., Johung, k., Goodwin, c.,... Hwang och. S. (2006). Senescence -asocierat ß -galaktosidas är lysosomalt p -gastosidas. Åldrande, 5, 187-195.
- Matthews, b. W. (2005). Strukturen för E. p-galaktosidas coli. C. R. Biologier, 328, 549-556.
- McCarter, J. D., & Visnar, s. G. (1994). Mekanismer för enzymatisk glykosidhydrolys. Nuvarande åsikt inom strukturell biologi, 4, 885-892.
- Richmond, m., Grå, j., & Stine, c. (1981). Beta-Galactosidase: Granskning av nyligen genomförd teknisk tillämpning, näringsproblem och immobilisering. J Dairy Sci, 64, 1759-1771.
- Wallenfels, K., & Weil, r. (1972). B-galaktosidas.

