Kalciumbikarbonat

- 1986
- 620
- PhD. Lennart Johansson
 Kalciumbikarbonat är ett oorganiskt salt i bikarbonatgruppen
Kalciumbikarbonat är ett oorganiskt salt i bikarbonatgruppen Vad är kalciumbikarbonat?
han kalciumbikarbonat Det är ett oorganiskt salt med CA -kemisk formel (HCO3)2. Det härstammar i naturen från kalciumkarbonat som finns i kalksten och mineralstenar som kalcit.
Kalciumbikarbonat är mer lösligt i vatten än kalciumkarbonat. Denna funktion har tillåtit bildandet av karstsystem i kalkstenberg och i strukturen av grottorna.
Grundvattnet som korsar sprickorna är mättande i deras koldioxidförskjutning (CO2).
Dessa vatten eroderar kalkstenar som släpper kalciumkarbonat (Caco3) att kalciumbikarbonat kommer att bildas enligt följande reaktion:
Tjuv3(s) +co2(g) +h2Eller (l) => ca (hco3)2(aq)
Denna reaktion inträffar i grottorna där mycket hårda vatten härstammar. Kalciumbikarbonat är inte i fast tillstånd utan i en vattenlösning, tillsammans med CA2+, Bikarbonat (HCO3-) och karbonatjonen (CO32-).
Därefter, genom att minska koldioxidmättnaden i vattnet, inträffar den omvända reaktionen, det vill säga omvandlingen av kalciumbikarbonat till kalciumkarbonat:
Ca (hco3)2(aq) => co2 (g) +h2Eller (l) +caco3 (S)
Kalciumkarbonat är lite lösligt i vattnet, detta gör att dess utfällning inträffar som ett fast. Den tidigare reaktionen är mycket viktig vid bildandet av stalaktiter, stalagmiter och annan tjocklek i grottorna.
Dessa steniga strukturer bildas från dropparna av vatten som faller från taket i grottorna. Caco3 närvarande i dropparna av vatten är kristalliserat för att bilda de ovannämnda strukturerna.
Det faktum att inte hitta kalciumbikarbonat i fast tillstånd har hindrat dess användning och hittat några exempel i detta avseende.
Struktur av kalciumbikarbonat
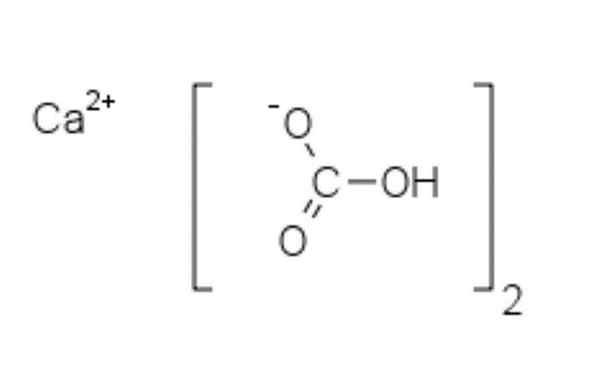 Kemisk struktur av kalciumbikarbonat
Kemisk struktur av kalciumbikarbonat I den övre bilden visas två HCO -anjoner3- och en caation2+ interagerande elektrostatiskt. Ca2+, Enligt bilden bör den vara belägen i mitten, eftersom så HCO3- De skulle inte avvisa med varandra för sina negativa avgifter.
Den negativa belastningen i HCO3- Det flyttar mellan två syreatomer, genom resonans mellan karbonyl C = O-gruppen och C-O-länken-; Medan han är i co32-, Detta flyttas mellan de tre syreatomerna, eftersom C-O-bindningen är oskyddad och kan få en negativ resonansbelastning.
Det kan tjäna dig: difenylaminGeometrierna för dessa joner kan betraktas som kalciumfärer omgiven av platta karbonatstrianglar med en hydrerad ände. När det gäller storleksförhållandet är kalcium anmärkningsvärt mindre än HCO -joner3-.
Vattenlösningar
Kalciumbikarbonat Du kan inte bilda kristallina fasta ämnen, och det består verkligen av vattenhaltiga lösningar av detta salt. I dem är jonerna inte ensamma, som i bilden, men omgiven av H -molekyler2ANTINGEN.
Varje jon är omgiven av en hydratiseringsfär, som kommer att bero på metall, polaritet och struktur för den upplösta arten.
Ca2+ Det koordinerar med syreatomerna i vattnet för att bilda en aquocomplex, CA (OH2)n2+, där n vanligtvis anses vara sex; Det vill säga en "vattenhaltig oktaedron" runt kalcium.
Medan HCO -anjoner3- De interagerar bra, antingen med vätebroar (eller2Co-h-oh2) eller med väteatomerna i vattnet i riktning mot den negativa belastningen (hoco2- H-oh, dipolinteraktion).
Dessa interaktioner mellan CA2+, Hco3- Och vatten är så effektivt att de gör kalciumbikarbonat mycket lösligt i det lösningsmedlet; Till skillnad från kalciumkarbonat (Caco3), där de elektrostatiska attraktionerna mellan CA2+ och CO32- De är mycket starka och utgör den vattenhaltiga lösningen.
Förutom vatten finns det co -molekyler2 runt, som reagerar långsamt för att bidra med mer HCO3- (Beroende på pH -värden).
Hypotetisk fast
Hittills förklarar jonstorlekar och belastningar i kalciumbikarbonat, inte heller närvaron av vatten, varför det inte finns någon fast förening; det vill säga rena kristaller som kan kännetecknas av x -ray kristallografi. Kalciumbikarbonat är inget annat än joner närvarande i vattnet från vilka de kavernösa formationerna fortsätter att växa.
Ja ca2+ och HCO3- De kunde isolera sig från vattnet och undvika följande kemiska reaktion:
Ca (hco3)2(aq) → Caco3(s) + co2(g) + h2Eller (l)
Då kan dessa grupperas i ett vitt kristallint fast ämne med stökiometriska proportioner 2: 1 (2HCO3/1ca).
Kan tjäna dig: 30 exempel på kemiska suspensionerDet finns inga studier om dess struktur, men det kan jämföras med den för natriumbikarbonat (som magnesiumbikarbonat, MG (HCO3)2, Det finns inte heller som fast) eller med kalciumkarbonat.
Stabilitet: natriumbikarbonat (NAHCO3) vs. Kalciumbikarbonat (CA (HCO3)2)
Natriumbikarbonat kristalliseras i det monokliniska systemet och kalciumbikarbonat i trigonal (kalcit) och ortorrombiska system (aragonite).
Om NA byts ut+ för CA2+, Det kristallina nätverket skulle destabiliseras av den större skillnaden i storlekar; det vill säga NA+ För att vara mindre bildar det ett mer stabilt glas med HCO3- Jämfört med CA2+.
Faktum är att CA (HCO3)2(aq) behöver vatten för att avdunsta så att dess joner kan grupperas i ett glas; Men det kristallina nätverket av detta är inte tillräckligt starkt för att göra det vid rumstemperatur. Vid uppvärmning av vattnet inträffar nedbrytningsreaktionen (ekvation uppifrån).
Att vara jon na+ I lösning skulle detta bilda glaset med HCO3- Innan dess termiska nedbrytning.
Anledningen till varför kalciumbikarbonat inte kristalliseras (teoretiskt) beror på skillnaden mellan joniska radioapparater eller storlekar på deras joner, som inte kan bilda en stabil kristall innan deras sönderdelning.
Kalciumbikarbonat (CA (HCO3)2) mot. kalciumkarbonat (Caco3)
Om å andra sidan tillsätts H+ Till de kristallina strukturerna av kalciumkarbonat skulle de drastiskt förändra sina fysiska egenskaper. Kanske faller deras smältpunkter avsevärt, och till och med kristallernas morfologier slutar modifieras.
Fysiska och kemiska egenskaper
Kemisk formel
Ca (hco3)2
Molekylvikt
162.11 g/mol
Fysiskt tillstånd
Det visas inte i fast tillstånd. Det finns i vattenlösning, och när värme appliceras för att avdunsta blir det kalciumkarbonat.
Vattenlöslighet
16,1 g/100 ml vid 0 ° C; 16,6 g/100 ml vid 20 ° C och 18,4 g/100 ml vid 100 ° C.
Dessa värden indikerar en stor affinitet av vattenmolekylerna av jonerna av kalciumbikarbonatet, såsom förklarats i föregående avsnitt. Samtidigt upplöses bara 15 mg kalciumkarbonat i en liter vatten, vilket återspeglar dess starka elektrostatiska interaktioner.
Eftersom kalciumbikarbonat kan inte bilda ett fast ämne, dess löslighet kan inte bestämmas experimentellt.
Men med tanke på de villkor som skapats av CO2 Löst i vattnet som omger kalkstenen, kunde massan av kalcium upplöst vid en T -temperatur beräknas; massa som skulle vara lika med koncentrationen av kalciumbikarbonat.
Kan tjäna dig: Benzyic Acid: Syntes, Transposition and UseVid olika temperaturer ökar den upplösta massan som visas i värdena vid 0, 20 och 100 ° C. Sedan bestäms det enligt dessa experiment hur mycket av kalciumbikarbonat Det löses i närheten av kalciumkarbonat, i ett vattenhaltigt medium förgasat med CO2.
När CO flyr från2 Gasiskt, kalciumkarbonat kommer att fälla ut, men inte kalciumbikarbonat.
Fusions- och kokpunkter
CURSKRISTAL NETWORK (HCO3)2 Det är mycket svagare än Caco3. Om det kunde erhållas i ett fast tillstånd och mäta temperaturen vid vilken den smälter inom en källa, skulle ett värde säkert erhållas långt under 899 ° C. På samma sätt bör samma förväntas för att bestämma kokpunkten.
Förbränning
Det är inte bränsle.
Risker
Eftersom denna förening inte existerar fast är det osannolikt att det representerar en risk att manipulera dess vattenhaltiga lösningar, eftersom båda jonerna CA2+ Som HCO3- De är inte skadliga för låga koncentrationer; Och därför kan den största risken, som skulle vara att äta sådana lösningar, endast bero på en farlig dos av kalcium intagna.
Om föreningen bildade ett fast ämne, till och med kanske fysiskt annorlunda än Caco3, Dess toxiska effekter kunde inte gå utöver enkelt obehag och resektion efter fysisk kontakt eller inandning.
Ansökningar
- Kalciumbikarbonatlösningar har använts under lång tid för att tvätta antika papper, särskilt konstverk eller historiskt viktiga dokument.
- Bikarbonatlösningar har använts för att förebygga osteoporos. I ett fall har emellertid biverkningar såsom hyperkalcemi, metabolisk alkalos och njursvikt observerats i ett fall.
- Kalciumbikarbonat ges ibland intravenöst för att korrigera den depressiva effekten av hypokalemi på hjärtfunktion.
- Det används för att lugna magsyra.
Referenser
- Wikipedia (2018). Kalciumbikarbonat. Taget från: i.Wikipedia.org
- Sirah Dubois (3 oktober 2017). Vad är kalciumbikarbonat? Återhämtat sig från: livestrong.com
- Science Learning Hub (2018). Karbonatkemi. Återhämtat sig från: scientelarn.org.nz
- Pubchem (2018). Kalciumbikarbonat. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov

