Kalciumpumpfunktioner, typer, struktur och drift
- 1441
- 327
- Per Eriksson
De Kalciumpump Det är en protein naturstruktur som ansvarar för att transportera kalcium genom cellmembran. Denna struktur är ATP -beroende och anses vara ett protein av ATPASA -typ, även kallad CA2+-Atpasa.
Ca2+-Atpasa finns i alla celler i eukaryota organismer och är viktiga för kalciumhomeostas i cellen. Detta protein utför primär aktiv transport, eftersom rörelsen av kalciummolekyler strider mot dess koncentrationsgradient.
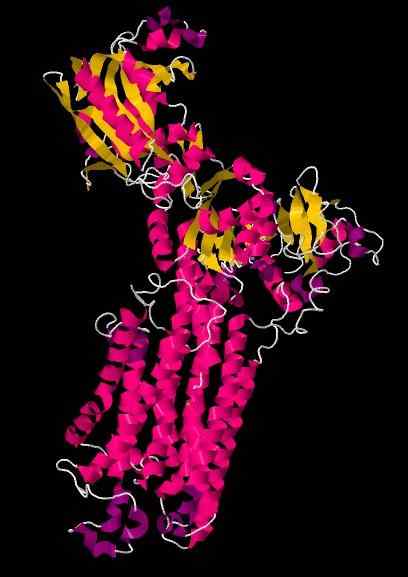
 Serca kristallografisk struktur.
Serca kristallografisk struktur.
Källa: WCNSAFFO [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] [TOC]
Kalciumpumpfunktioner
Ca2+ Det uppfyller viktiga papper i cellen, så deras reglering inom dem är grundläggande för deras korrekta operation. Fungerar ofta som en andra budbärare.
I extracellulära utrymmen koncentrationen av CA2+ Det är ungefär 10.000 gånger högre än inom celler. En ökning av koncentrationen av denna jon i cellcytoplasma utlöser olika svar, såsom muskelkontraktioner, frisättning av neurotransmitter och glykogennedbrytning.
Det finns flera sätt att flytta dessa joner från cellerna: passiv transport (ospecifik utgång), jonkanaler (rörelse till förmån för dess elektrokemiska gradient), antiportad sekundär aktiv transport (NA/CA) och primär aktiv transport med pump ATP -beroende.
Till skillnad från de andra mekanismerna för förskjutning av CA2+, Pumpen fungerar i vektorform. Det vill säga jonen rör sig i en riktning så att den bara fungerar genom att utvisa dem.
Cellen är extremt känslig för CA -koncentrationsförändringar2+. Genom att presentera en så markant skillnad med sin extracellulära koncentration, så det är så viktigt att effektivt återställa sina normala cytosoliska nivåer.
Kan tjäna dig: mesosomGrabbar
Tre typer av CA har beskrivits2+-Atasas i djurceller, enligt deras platser i cellerna; Pumparna belägna i plasmamembranet (PMCA), de som ligger i endoplasmatisk retikulum och kärnmembranet (SERCA) och de som finns i Golgi -apparatmembranet (SPCA).
SPCA -bomber transporterar också Mn -joner2+ som är kofaktorer av olika enzymer i matrisen i Golgi -apparaten.
Jästceller, från andra eukaryoteringsorganismer och växtceller har andra typer av CA2+-Mycket speciell Atasas.
Strukturera
PMCA -pump
I plasmamembranet hittar vi den aktiva antiportiska transporten Na/Ca, som är ansvarig för förskjutningen av en betydande mängd CA2+ I vila och aktivitetsceller. I de flesta celler i vila är chefen för transport av kalcium utåt PMCA -pumpen.
Dessa proteiner består av cirka 1.200 aminosyror och har 10 transmembranala segment. I cytosolen finns det fyra huvudenheter. Den första enheten innehåller den aminoterminala gruppen. Den andra har grundläggande egenskaper, som gör det möjligt för fosfolipider att gå med i aktivatorer.
I den tredje enheten finns en asparagesyra med katalytisk funktion, och "nedströms" av detta en fluorescein -iso -cykelbindande band, i ATP Union Domain.
I den fjärde enheten är Mastery of Union till Calmodulin, erkännandeplatserna för vissa kinaser (A och C) och de bindande banden i CA2+ Alosterisk.
SERCA PUMP
SERCA -pumpar är i stor mängd i sarkoplasmatisk retikulum av muskelceller och deras aktivitet är relaterad till sammandragning och avkoppling i muskelrörelsescykeln. Dess funktion är att transportera CA2+ Från cytosolen i cellen till retikulummatrisen.
Kan tjäna dig: basal stratum: egenskaper och funktionerDessa proteiner består av en enda polypeptidkedja med 10 transmarknadsdomäner. Dess struktur är i princip lika med PMCA -proteiner, men den skiljer sig åt att de bara har tre enheter inom cytoplasma, är det aktiva stället i den tredje enheten.
Driften av detta protein kräver en belastningsbalans under jontransport. Två Ca2+ (av ATP hydrolyserad) förflyttas från cytosolen till retikelmatrisen, mot en mycket hög koncentrationsgradient.
Denna transport inträffar antiportiskt, för samtidigt två timmar+ De riktas till cytosol från matrisen.
Driftsmekanism
Sercabomber
Transportmekanismen är uppdelad i två E1- och E2 -tillstånd. I E1 är unionens platser som presenterar en hög affinitet för CA2+ De riktas till cytosolen. I E2 riktas unionens platser mot lumen i retikulum som presenterar en låg affinitet för CA2+. De två cajonerna2+ samlas efter överföringen.
Under unionen och överföringen av CA2+, Konformationella förändringar inträffar, inklusive öppningen av proteinets m -domän, som är mot cytosolen. Jonerna är sedan lättare bundna till de två fackliga platserna för nämnda domän.
Föreningen mellan de två cajonerna2+ främjar en serie strukturella förändringar i protein. Bland dem rotationen av vissa domäner (domän A) som omorganiserar bombenheterna, vilket möjliggör öppningen mot matrisen på retikulum att frigöra jonerna, som är avkopplade tack vare minskningen av affinitet i unionens platser.
Protonerna h+ och vattenmolekyler stabiliserar föreningsstället för CA2+, vilket får domänen att rotera igen till sitt ursprungliga tillstånd och stänga tillgången till endoplasmatisk retikulum.
Kan tjäna dig: CariocinesisPMCA -pumpar
Dessa typer av pumpar finns i alla eukaryota celler och ansvarar för utvisning av CA2+ mot det extracellulära utrymmet för att hålla sin koncentration in i cellerna stabila.
I detta protein transporteras en cajon2+ Av hydrolyserad ATP. Transport regleras av nivåerna av kalmodulinproteinet i cytoplasma.
Genom att öka CA -koncentrationen2+ Cytosoliska, kalmodulinnivåer ökar, som är bindande till kalciumjoner. CA -komplexet2+-Calmodulin, samlar sedan PMCA Bomb Bomb -webbplatsen. Det finns en konformationell förändring i pumpen som gör att öppningen till det extracellulära utrymmet kan utsättas.
Kalciumjoner släpps, vilket återställer normala nivåer inuti cellen. Följaktligen CA -komplexet2+-Calmodulin är Desasambla, som returnerar pumpens konformation till dess ursprungliga tillstånd.
Referenser
- Brini, m., & Carafoli, och. (2009). Kalciumpumpar i hälsa och sjukdom. Fysiologiska recensioner, 89(4), 1341-1378.
- Carafoli, e., & Brini, M. (2000). Kalciumpumpar: strukturell grund för och mekanism för kalciumtransmembrantransport. Nuvarande åsikt i kemisk biologi, 4(2), 152-161.
- Devlin, t. M. (1992). Lärobok för biokemi: Med kliniska korrelationer.
- Latorre, R. (Ed.). (nitton nittiosex). Biofysik och cellfysiologi. Sevilla universitet.
- Lodish, h., Darnell, J. OCH., Berk, A., Kaiser, c. TILL., Krieger, m., Scott, m. P., & Matsudaira, s. (2008). Mollecular cellbiologi. Macmillan.
- Pocock, g., & Richards, c. D. (2005). Mänsklig fysiologi: Medicinens bas. Elsevier Spanien.
- Voet, D., & Voet, J. G. (2006). Biokemi. Ed. Pan -amerikansk medicin.
- « Eumetazoa -egenskaper, taxonomi och klassificering
- Colombianska tallegenskaper, livsmiljöer, reproduktion och användningar »

