Boro -historia, egenskaper, struktur, användningar

- 1114
- 73
- Johan Eriksson
han bor Det är ett icke -metalliskt element som leder grupp 13 i det periodiska tabellen och representeras med den kemiska symbolen B. Hans atomnummer är 5 och är det enda icke -metalliska elementet i hans grupp; Även om vissa kemikalier anser att det är en metalloid.
Det presenteras som ett svartbrunt pulver och är i en andel på 10 ppm i förhållande till jordskorpan. Därför är det inte ett av de vanligaste elementen.
 Boro -prov med renhet runt 99%. Källa: Alajhasha [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Boro -prov med renhet runt 99%. Källa: Alajhasha [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Det är en del av flera mineraler som borax eller natriumborat, detta är det vanligaste bormineralet. Det finns också Kurnite, en annan form av natriumborerat; Colemanite eller kalciumborat; och ulexit-, natrium- och kalciumborato.
Boratos extraheras i USA, Tibet, Kina och Chile med en världsproduktion på cirka två miljoner ton per år.
Detta element har tretton isotoper, som är det vanligaste elvaB, som utgör 80,1% av boren och 10B, som bildar de återstående 19,9%.
Bor är ett väsentligt spår för växter som ingriper i syntesen av vissa viktiga växtproteiner och bidrar till vattenabsorption. Hos däggdjur verkar det nödvändigt för benhälsa.
Även om boren upptäcktes 1808 av den engelska kemisten Sir Humphry Davy, och franska kemister Jacques Thérnard och Joseph Gay-Lussac, sedan början av vår era i Kina användes Borax i utarbetandet av keramik i emaljen.
Bor och dess föreningar har många användningsområden och tillämpningar, allt från deras användning i livsmedelsbevarande, särskilt margarin och fisk, tills man använder i behandlingen av cancer tumörer i hjärnan, urinblåsan, prostata och andra organ och andra organ och andra organ.
Boren är inte särskilt löslig i vatten, men dess föreningar är. Detta kan vara en koncentrationsmekanism för bor, liksom en källa till förgiftning med elementet.
[TOC]
Historia
Bakgrund
Sedan avlägsna tider har mannen använt borföreningar i olika aktiviteter. El Borax, ett mineral som kallas Tincal, användes i Kina under 300 år.C. I utarbetandet av emaljkeramik.
Den persiska alkemisten (865-925) gjorde det första omnämnandet av Boro-föreningar. Rhazes klassificerade mineralerna i sex klasser, varav en var Borocies som inkluderade bor.
Agricola, cirka 1600, rapporterade användningen av borax som ett flöde i metallurgi. 1777 erkändes närvaron av borsyra i en ström av varma källor nära Florens.
Upptäckt av elementet
Humphry Davy, genom elektrolysen av en boraxlösning, observerade ansamlingen av en svart fällning i en av elektroderna. Han värmde också boroxiden (b2ANTINGEN3) Med kalium, producera ett svartvatt brunt pulver som var den kända formen av bor.
Gay-Lussac och Thénard reducerade borsyra vid höga temperaturer i närvaro av järn för att producera bor. De visade också den omvända processen, det vill säga där borsyra är en produkt av boroxidation.
Identifiering och isolering
Jöns Jakob Berzelius (1827) uppnådde identifieringen av Boro som ett nytt element. 1892 lyckades den franska kemisten Henri Moissan producera bor med 98% renhet. Även om det påpekas att boren producerades rent av den amerikanska kemisten Ezekiel Weintraub, 1909.
Egenskaper
Fysisk beskrivning
Kristallint fast eller svartbrunt amorft pulver.
Kan tjäna dig: Peroxider: Egenskaper, nomenklatur, användning, exempelMolmassa
10,821 g/mol.
Smältpunkt
2076 ºC.
Kokpunkt
3927 ºC.
Densitet
-Vätska: 2,08 g/cm3.
-Kristallin och amorf vid 20 ºC: 2,34 g/cm3.
Fusionsvärme
50,2 kJ/mol.
Förångningsvärme
508 kJ/mol.
Molorisk kapacitet
elva.087 J/(mol · k)
Joniseringsenergi
-Första nivå: 800.6 kJ/mol.
-Andra nivå: 2.427 kJ/mol.
-Tredje nivå: 3.659,7 kJ/mol.
Elektronnegativitet
2.04 på Pauling -skalan.
Atomradio
21.00 (empirisk).
Atomvolym
4,16 cm3/mol.
Värmeledningsförmåga
27,4 vikt/m.K
Elektrisk resistans
~ 106 Ω.M (vid 20 ° C).
Höga temperaturer bor är en bra elektrisk ledare, men vid omgivningstemperatur blir det nästan en isolator.
Hårdhet
~ 9,5 på Mohs -skalan.
Reaktivitet
Bor påverkas inte av saltsyra vid kokningstemperatur. Det omvandlas emellertid av varm salpetersyra till borsyra (h3Bo3). Boro uppför sig kemiskt som en icke -metall.
Reagerar med alla halogener för att ge trihaluro, mycket reaktiv. Dessa har den allmänna formeln BX3, Där X representerar halogenen.
Det kombineras med flera element för att komma från Boruro. Några av dem är bland ämnena med större hårdhet; Till exempel Boron Nitride (BN). Bor kombineras med syre för att bilda borrioxid.
Elektronisk borstruktur och konfiguration
Länkar och strukturella enheter i bor
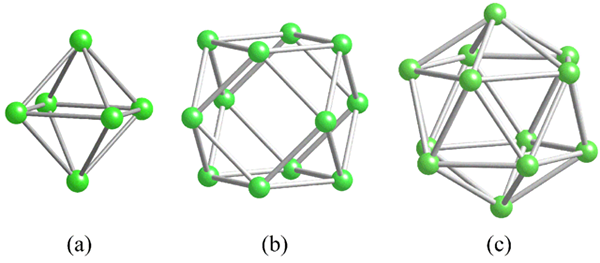 Geometrier av de gemensamma strukturella enheterna för bor. Källa: MaterialScientist [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Geometrier av de gemensamma strukturella enheterna för bor. Källa: MaterialScientist [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Innan du adresserar borstrukturer (kristallina eller amorfa) är det viktigt att komma ihåg hur deras atomer kan kopplas. B-B-länken är i kovalent essens; Inte bara det, utan eftersom naturligt Boro -atomer har elektronisk brist kommer de att försöka leverera den i sina länkar på ett eller annat sätt.
I boret finns en speciell typ av kovalent bindning: den för tre centra och två elektroner, 3C2E. Här delar tre boratomer två elektroner och definierar en triangel, ett av de många ansikten som finns i deras strukturella polyhedros (överlägsen bild).
Från vänster till höger har vi: Octaedro (A, B6), Cuboctaedro (B, B12) Och isocasedro (c, b12 också). Alla dessa enheter delar en funktion: de är fattiga i elektroner. Därför måste de koppla kovalent mellan sig; Och resultatet är ett överraskande länkparti.
I varje triangel av dessa polyhedros finns 3C2E -länken närvarande. Annars kunde det inte förklaras hur bor, kapabel att bara bilda tre kovalenta bindningar enligt Valencia Link Theory, kan ha upp till fem länkar i dessa polyhedrala enheter.
Borstrukturerna består sedan av ett arrangemang och upprepning av dessa enheter som slutar definiera en kristall (eller ett amorft fast ämne).
Boro a-romboédrico
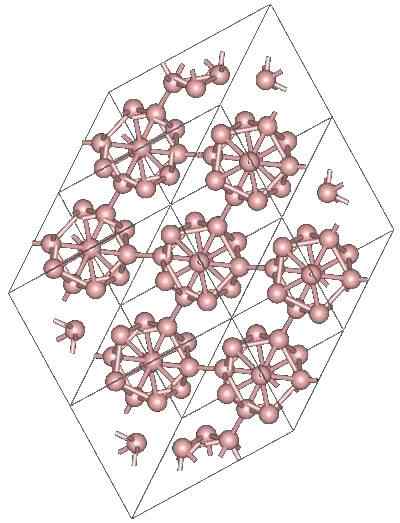 Kristallin struktur i a-romboédrico-boren alotropisk. Källa: MaterialScientist på English Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Kristallin struktur i a-romboédrico-boren alotropisk. Källa: MaterialScientist på English Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Det kan finnas andra polyhedrala enheter av Boro, liksom en förening endast av två atomer, b2; En bor "linje" som måste kopplas till andra atomer efter dess höga elektroniska brist.
Icosaedro är överlägset den föredragna enheten i boren; Den som känns bättre. I den övre bilden uppskattas till exempel hur dessa B -enheter12 De sammanflätas för att definiera den rambohedrala kristallen i boren-a.
Om en av dessa Icosaedros ville vara isolerade, skulle det vara en komplicerad uppgift, eftersom deras elektroniska brist tvingar dem att definiera en kristall där var och en tillhandahåller de elektroner som de andra grannarna behöver.
P-romboédrico bor
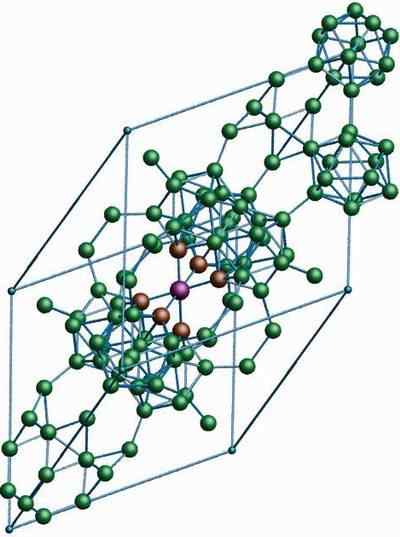 Kristallin struktur i p-romboédrico-boren alotropisk. Källa: MaterialScientist på English Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Kristallin struktur i p-romboédrico-boren alotropisk. Källa: MaterialScientist på English Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] P-romboédrico-boren alotropisk, som namnet redan indikerar, har Rhomboédica-kristaller såväl som bor-a; Det skiljer sig dock i dess strukturella enheter. Det ser ut som ett utomjordiskt fartyg tillverkat med boratomer.
Det kan tjäna dig: litiumhydroxid (LIOH)Om du noggrant kan se icosahedric -enheterna på ett diskret och sammanslaget sätt (i mitten). Det finns också B -enheter10 och ensama boratomer som fungerar som en bro för de ovannämnda enheterna. Av allt är detta den mest stabila boren Alotrope.
Borrem
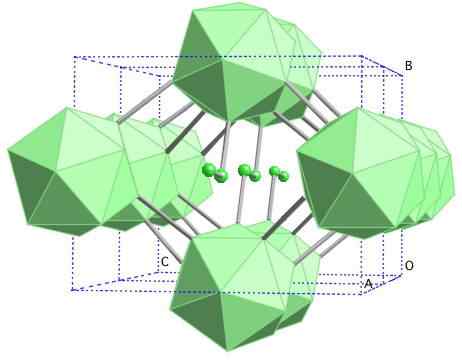 Kristallin struktur av bor-y. Källa: MaterialScientist på English Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Kristallin struktur av bor-y. Källa: MaterialScientist på English Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] I denna bor -alotrop samordnas enheter B2 och b12. B2 presenterar så mycket elektronisk brist att faktiskt ta bort elektroner från B12 Och det finns därför en jonisk karaktär inom detta fasta. Det vill säga, de är inte bara kovalent förenade, utan det finns typ elektrostatisk attraktion [B2-] [B12+].
Boro-y kristalliserar i en gema-saltstruktur, samma som för NaCl. Andra alotroper från bor till högt tryck (20 GPa) och temperaturer (1800 ° C) erhålls och förblir sedan stabila under normala förhållanden. Dess faktiska stabilitet konkurrerar med den för ß-romboédrico-bor.
Kubik och amorf
Andra alotroper av boren består av aggregat av B -atomer som om de var förenade med en metallbindning, eller som om de var joniska kristaller; det vill säga, det är en kubisk bor.
Också, och inte minst, är den amorfa boren, vars disposition av B -enheter12 Det är slumpmässigt och rörigt. Det presenteras som ett fint eller glasartat pulver av mörka färger och ogenomskinlig brun.
Bore
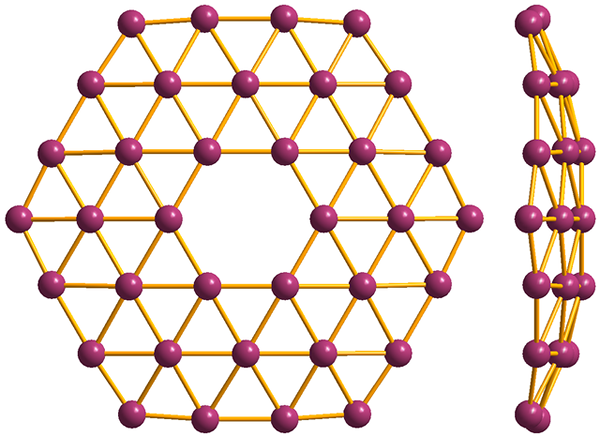 Struktur av den enklaste av borofenos, B36. Källa: MaterialScientist [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Struktur av den enklaste av borofenos, B36. Källa: MaterialScientist [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Och slutligen är den mest nya och bisarra alotropiken i Boro: Borofenos (högre bild). Den består av ett apa lager av boratomer; extremt tunn och analog med grafen. Observera att den behåller de berömda trianglarna, karakteristiska för den elektroniska bristen som dess atomer lider.
Förutom borofenos, av vilka B36 Det är det enklaste och litet, det finns också Boros kluster. Borosferene (bild nedan) består av en sfärisk bur som liknar en boll av fyrtio atomer av boro, b40; Men istället för att ha släta kanter är de plötsliga och oregelbundna:
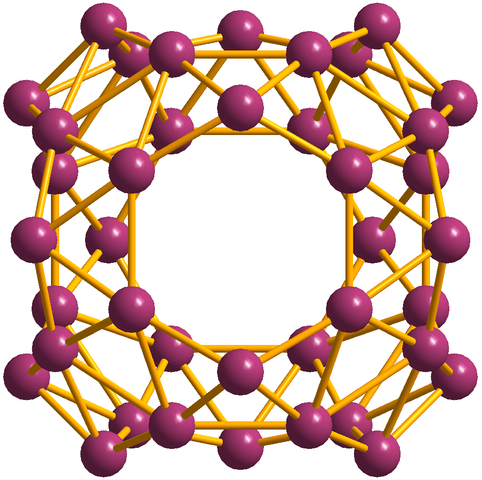 Borosferenos -enheten, B40. Källa: MaterialScientist [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Borosferenos -enheten, B40. Källa: MaterialScientist [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Elektronisk konfiguration
Borens elektroniska konfiguration är:
[Han] 2s2 2 p1
Därför tre elektroner från Valencia. Han saknar fem till för att slutföra sin okteto av Valencia, och han kan knappt bilda tre kovalenta bindningar; Jag skulle behöva en fjärde dativlänk för att slutföra din oktett. Bor kan förlora sina tre elektroner för att få ett oxidationstillstånd på +3.
Erhållande
Boren isoleras genom att reducera borsyra med magnesium eller aluminium; Metod som liknar Gay-Lussac och Thénard. Det har svårigheten att borföroreningar med Boruro för dessa metaller.
Ett prov med hög renhet kan erhållas genom en gasformig reduktion av borriklorid eller tribromid, med väte på elektriskt tantriskt uppvärmda filament.
En borr med hög renhet framställs genom nedbrytning vid höga diboranotemperaturer, följt av rening genom fusion av zon- eller czocharalski -processer.
Ansökningar
Inom industrin
Elemental bor har använts i härdningen av stål. I en legering med järnet som innehåller en Boron mellan 0,001 och 0,005 %. Det används också i den icke -järnindustrin, vanligtvis som deoxidant.
Dessutom används bor som en lerig i kopparbaserade legeringar och koppar med hög konduktans. I halvledarindustrin tillsätts små mängder Boro som dopningsmedel för Silicon och Germanio.
Kan tjäna dig: Isopreno: Struktur, egenskaper, applikationerBorooxid (b2ANTINGEN3) blandas med kiseldioxid för att göra ett värmebeständigt glas (borosylikatglas), används i köksredskap och viss laboratorieutrustning.
Boro Carbide (B4C) Det är en extremt hård substans som används som slipmedel och förstärkningsmedel i kompositmaterial. Aluminium boruro (alb12) Det används som en diamantdammersättare för frostat och polerat.
Boro används i legeringar, till exempel i sällsynta jordartsmagneter, legering med järn och neodymium. De bildade magneterna används vid tillverkning av mikrofoner, magnetomkopplare, hörlurar och partikelacceleratorer.
Inom medicin
Kapaciteten för Boro-10-isotopen (10B) För att fånga neutroner har utsläpp av a -typ strålning använts för behandling av hjärntumörer i en teknik som kallas borneutronfångsterapi (BNCT).
han 10B i form av föreningar ackumuleras i cancer tumör. Därefter strålas tumörzonen med neutroner. Dessa interagerar med 10B, vad som orsakar utsläpp av a -partiklar. Dessa partiklar har en hög relativ biologisk effekt och på grund av deras stora storlek har de liten räckvidd.
Så den destruktiva verkan av a -partiklar är begränsad i tumörceller och utför sin förstörelse. BNCT används också vid behandling av tumörer i nacke, lever, urinblåsan och prostatatumlar.
Biologisk handling
En liten mängd borsyra eller boreratformat bor är nödvändig för tillväxten av många växter. En borbrist manifesteras i deformerad tillväxt av växter; grönsakernas "bruna hjärta"; och "torr röt" av sockerbetor.
Bor kan vara nödvändig i små mängder för att upprätthålla benhälsa. Det finns studier som indikerar att bristen på bor skulle vara involverad i artritgenerering. Det skulle också ingripa i hjärnfunktioner som minne och koordination ögonman.
Vissa experter påpekar att 1,5 till 3 mg bor bör inkluderas i den dagliga dieten.
Risker och försiktighet
Bor, boroxid, borsyra och boratos, anses vara icke -toxiskt. LD50 för djur är 6 g bor/kg kroppsvikt, medan ämnen med en LD50 större än 2 g/kg kroppsvikt anses vara icke -toxisk.
Å andra sidan orsakar konsumtionen av mer än 0,5 mg/bordag under 50 dagar mindre matsmältningsproblem, vilket tyder på toxicitet. Vissa rapporter påpekar att ett överskott i borintaget kan påverka magen, levern, njurarna och hjärnan.
På samma sätt har kortvariga irriterande effekter indikerats i nasofarynx, övre luftvägar och ögonen för exponering för bor.
Rapporterna om toxiciteten hos bor är knappa och i många fall presenteras toxicitet vid mycket höga doser, högre än den allmänna befolkningen är utsatt.
Rekommendationen är att övervaka borinnehållet i mat, särskilt grönsaker och frukt. Statliga hälsobyråer måste övervaka att koncentrationen av vattenbor inte överskrider de tillåtna gränserna.
Arbetare som utsätts för damm som innehåller bor bör bära masker som skyddar luftvägarna, handskar och speciella stövlar.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2019). Borallok. Hämtad från: i.Wikipedia.org
- Prof. Robert J. Lancashire. (2014). Föreläsning 5b. Elementens struktur (icke-metaller, b, c). Department of Chemistry, University of the West Indies, Mona Campus, Kingston 7, Jamaica. Återhämtad från: kem.Uwimona.Edu.Jm
- Manisha Lalloo. (28 januari 2009). Ultra-pure borstruktur upptäckt. Kemivärld. Återhämtat sig från: Chemistryworld.com
- Klocka. (16 december 2018). En profil av metallboren. Återhämtat sig från: TheBalance.com
- Redaktörerna för Enyclopaedia Britannica. (2019). BOR. Återhämtat sig från: Britannica.com
- Byrå för giftiga ämnen och sjukdomsregister. (2010). Toxfaqs ™ på bor. [Pdf]. Hämtad från: ATSDR.CDC.Gov
- Helmestine, Anne Marie, PH.D. (6 februari 2019). Bor Chemical & Physical Egenskaper. Återhämtat sig från: tankco.com

